
筆者小結:
本研究發現,維生素 K2 有助於保護肝臟,減少高脂飲食導致的非酒精性脂肪肝(NAFLD)。補充維生素 K2 可以減少脂肪囤積,降低內臟脂肪與肝臟脂肪變性,並改善肝臟的健康狀況,對預防和改善 NAFLD 可能有效。
此外,研究顯示,維生素 K2 可以降低影響膽固醇合成的關鍵酶 HMGR,可能幫助調節膽固醇代謝。然而,維生素 K2 並未能顯著改善 NAFLD 小鼠的血脂異常(TC、HDL),也沒有對脂聯素(APN)、抗氧化能力(SOD)、線粒體功能(AlaDH)及骨鈣素(ucOC)產生明顯影響,顯示它的作用可能與這些機制無關。
雖然研究結果顯示維生素 K2 可能是一種潛在的 NAFLD 治療方法,但其具體的作用機制仍需更多研究。未來應進一步探索,維生素 K2 是否透過調控線粒體功能、影響維生素 K 依賴蛋白羧化,或與鐵死亡(ferroptosis)相關機制來影響 NAFLD,以確定其臨床應用價值。
摘要
近年來,非酒精性脂肪肝(NAFLD) 已成為全球成人及兒童/青少年常見的隱形健康殺手[1]。歐洲肝病研究協會(EASL) 將 NAFLD 定義為 肝細胞內脂肪變性 >5% 或 磁共振成像(MRI)下質子密度脂肪分數 >5.6%,並排除其他肝脂肪變性原因,同時設置酒精攝取量上限(男性 ≤30 g/天,女性 ≤30 g/天)[2]。
根據肝組織學特徵,NAFLD 可分為兩種病理類型:非酒精性脂肪肝(NAFL) 和 非酒精性脂肪性肝炎(NASH)[3]。NAFL 主要特徵為 肝脂肪變性,伴隨輕度小葉間炎症浸潤,或無炎症[3]。NASH 則以 肝細胞氣球樣變性、炎症浸潤及纖維化 為特徵[3]。
NAFLD 的發病與多種因素相關,主流觀點認為其屬於 代謝綜合症(Metabolic Syndrome) 的一部分[4],其發病機制主要與 肥胖及胰島素抵抗 相關。因此,大多數患者伴有 肥胖,且易罹患 2 型糖尿病、高血壓或血脂異常[3]。然而,也有研究報導,部分無胰島素抵抗或肥胖的患者,在接受胰十二指腸切除術後,可能發展為 NAFLD[5]。
在臨床上,除肝臟移植外,尚無公認的有效方法可逆轉 NAFLD。目前,減重與運動 等生活方式干預仍是 NAFLD 的主要治療手段[6]。近期研究顯示,吡格列酮(Pioglitazone)與維生素 E 聯合治療,可改善 2 型糖尿病與 NASH 患者的肝組織炎症及氣球樣變性[7]。尋找 有效的 NAFLD 預防及治療方法 已成為臨床關注的焦點。
維生素 K 在體內存在兩種形式:植物甲萘醌(維生素 K1,PK) 和 細菌合成的甲基萘醌(維生素 K2,MKs)[8]。維生素 K2(VK2) 屬於 維生素 K 家族,其中包括多種亞型,其差異來自 異戊二烯側鏈長度不同(MK-n)[9]。
MK-7 在體內的 半衰期長達 68 小時,相比之下,PK 的半衰期僅為 1–2 小時[10]。因此,MK-7 在循環中較穩定,也是 體內主要的 MK 形式[11]。
介紹
近年來,適量補充維生素 K2 在多種疾病中的作用逐漸受到關注。例如,維生素 K2 可抑制血管鈣化[12]、骨關節炎[13] 及哮喘[14]。
此外,近年來研究也關注 維生素 K2 在調控內分泌紊亂中的潛在作用。例如,MK-7 可顯著改善多囊卵巢綜合症(PCOS)患者的體脂量、胰島素抵抗及血清三酸甘油酯水準[15]。另外,每日攝取 MK-7(360 µg/天)可降低 2 型糖尿病患者的空腹血糖及糖化血紅蛋白水準[16]。
值得注意的是,一項針對 348 名韓國受試者的病例對照研究顯示,維生素 K 攝取充足可降低 NAFLD 風險[17]。
過去的 維生素 K2 研究 主要集中於 促進肝再生及抑制肝細胞癌細胞生長[18,19],但 維生素 K2 是否對 NAFLD 具有預防與保護作用,以及其相關機制,仍需進一步研究。
本研究旨在探討 維生素 K2 在 NAFLD 形成過程中的預防與治療作用,並研究 維生素 K2 影響 NAFLD 的分子機制。
材料與方法
化學試劑與試劑盒
維生素 K2 由中國汕頭市 Sungen Bioscience Co., Ltd. 提供,藥物純度為 99.63%。生化檢測試劑盒,包括 總膽固醇(TC)、高密度脂蛋白(HDL)、丙氨酸轉氨酶(ALT)、天冬氨酸轉氨酶(AST)和超氧化物歧化酶(SOD),均來自中國南京 建成生物工程研究所(Nanjing Jiancheng Bioengineering Institute)。脂聯素(APN) 的 ELISA 試劑盒購自中國上海 朗頓生物技術有限公司(Shanghai Langton Biotechnology Co., Ltd.)。HMG-CoA 還原酶(HMGR)、未羧化骨鈣素(ucOC) 和 丙氨酸脫氫酶(AlaDH) 試劑盒購自中國鹽城 江蘇酶標生物技術有限公司(Jiangsu Enzyme Labeled Biotechnology Co., Ltd.)。
實驗設計
C57BL/6 雄性小鼠飼養於恆溫 23 ± 2°C、濕度 60–75% 的動物實驗室,並且每 12 小時 交替光照與黑暗。根據我們的前期研究[]與初步實驗,確定了本實驗中 維生素 K2(VK2) 的干預劑量。在 1 週適應性飼養 後,共 42 隻小鼠 隨機分為 7 組(n=6),具體如下:
- 對照組(C)
- 對照 + VK2 組(C + VK2)(0.1 mg/kg, 0.2 mg/kg, 0.4 mg/kg)
- 高脂飲食組(HFD)
- 高脂飲食 + VK2 低劑量組(HFD + VK2(L))(0.1 mg/kg)
- 高脂飲食 + VK2 中劑量組(HFD + VK2(M))(0.2 mg/kg)
- 高脂飲食 + VK2 高劑量組(HFD + VK2(H))(0.4 mg/kg)
- 高脂飲食 + 載體對照組(HFD + V)
動物與建模
C57BL/6 雄性小鼠(6–8 週齡,20 ± 2 g)購自中國 大連醫科大學 SPF 實驗動物中心。
所有對照組小鼠餵養 標準飼料,而 NAFLD 小鼠則餵養 高脂飲食。高脂飲食成分為 每 100 g 含蛋白質 26.2 g、碳水化合物 26.3 g、脂肪 34.9 g(由江蘇協同製藥生物工程有限公司提供)。不同劑量組的小鼠每天與飼料一起餵食 VK2,持續 8 週。VK2 以 大豆油溶解 並經灌胃給藥。成功建模的標準包括:
- 體重增加 ≥20%
- HE 染色 下觀察到肝臟空泡化
在建模期間,每 3 天 記錄食物攝取量與腹圍變化,每 週 測量一次體重。每 4 週 使用小動物體組成分析儀評估體脂、體液與瘦體質量,並計算體脂百分比(體脂重量/總體重)。
建模最後一天,所有小鼠經 12 小時禁食 後,以 戊巴比妥 安樂死,並立即收集血液與組織樣本。觀察並記錄每隻小鼠的 肝臟外觀、大小、顏色變化 以及 內臟脂肪分佈,測量 肝臟濕重 及 附睪周圍脂肪重量。
動物實驗倫理聲明
本研究的所有動物實驗均遵循 《實驗動物照護與使用指南》(Guide for the Care and Use of Laboratory Animals),並獲得 大連醫科大學倫理委員會(AEE20051) 授權。所有動物實驗均依據 ARRIVE 指南 的建議實施,所有方法均符合相關規範與法規。
血清分析
血清中 TC、HDL、SOD 的濃度使用 生化試劑盒 測定。APN、HMGR、ucOC 和 AlaDH 濃度則通過 ELISA 試劑盒 測定。所有血漿樣本在 −80℃ 下保存,直到進行分析。
組織學分析
從小鼠肝臟 左葉 取出數塊組織:
- 部分組織 固定於 10% 福爾馬林 溶液中,隨後進行石蠟包埋、切片、HE 染色,以觀察:
- 肝脂肪變性
- 炎症
- 微小肉芽腫
- 肝細胞空泡化
- 肝纖維化
- 脂肪肝染色評分(steatosis scoring):每張切片 隨機選取 3 個視野 計算脂肪變性程度(脂肪變性細胞數/總細胞數),並評分:
- 0 = 無明顯變性
- 1 = ≤ 25%
- 2 = 25–50%
- 3 = 50–75%
- 4 = > 75%
數據分析
所有數據以 均值 ± 標準誤(SEM) 表示,並使用 GraphPad Prism 8.1 進行統計分析。
- 統計比較採用 單因素方差分析(ANOVA),並通過 Tukey 多重比較檢驗 進行組間比較。
- 顯著性水準設定為 p < 0.05。
- ELISA 測試結果由 Gen5、ELISACalc 等軟體 分析。微孔板讀取的 OD 值 用於標準曲線擬合與濃度計算。
結果(Results)
維生素 K2 對小鼠基本生理指標的影響
小鼠的基本生理指標變化是 NAFLD 發展的重要指標,本研究從以下四個方面進行分析。
維生素 K2 對 NAFLD 小鼠體重、腹圍、食物攝取量及飲水量的影響
- 圖 1A 顯示了不同干預組的小鼠外觀。
- 高脂飲食組(HFD) 的小鼠明顯 體型較大,肥胖程度更高,相比之下,維生素 K2 干預組的小鼠體型相對較小(圖 1A)。
圖1
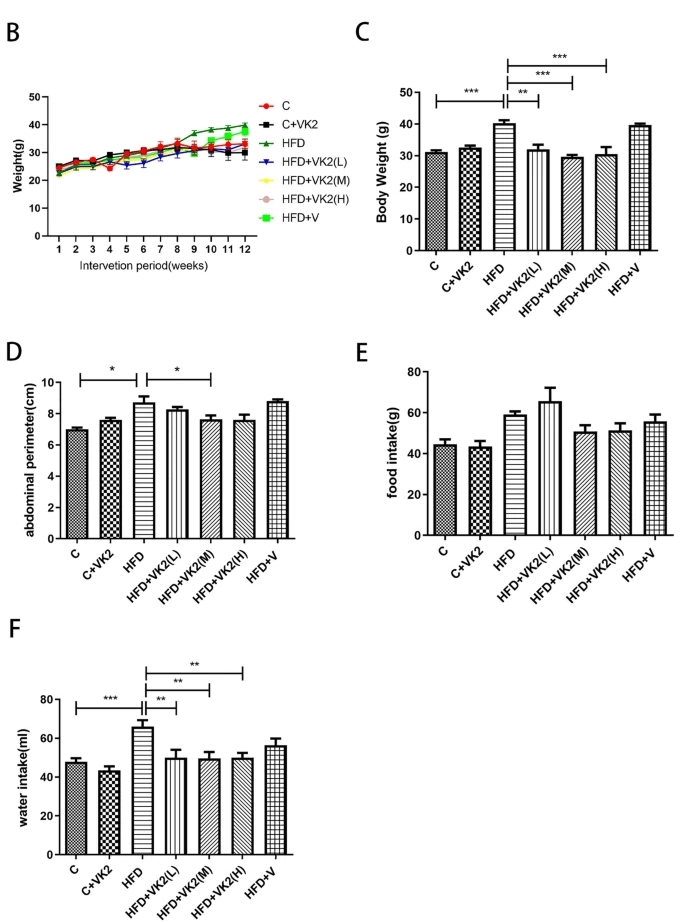
維生素 K2 對高脂飲食小鼠體重、腹圍、食物攝取量及飲水量的影響
- (A) 維生素 K2 對高脂飲食小鼠體型的影響(餵養 12 週後)
- (B) 維生素 K2 對各組小鼠體重變化的影響
- (C) 維生素 K2 對小鼠 12 週內體重變化的影響
- (D) 不同劑量的維生素 K2 對高脂飲食小鼠腹圍的影響
- (E) 不同劑量的維生素 K2 對高脂飲食小鼠食物攝取量的影響
- (F) 不同劑量的維生素 K2 對高脂飲食小鼠飲水量的影響
圖例中的縮寫說明:
- C:對照組(Control group)
- C + VK2:對照 + 維生素 K2 組(Control + Vitamin K2 group)
- HFD:高脂飲食組(High-fat diet group)
- HFD + VK2(L):高脂飲食 + 0.1 mg/kg 維生素 K2 組
- HFD + VK2(M):高脂飲食 + 0.2 mg/kg 維生素 K2 組
- HFD + VK2(H):高脂飲食 + 0.4 mg/kg 維生素 K2 組
- HFD + V:高脂飲食 + 載體對照組
數據以 均值 ± 標準誤(SEM) 表示(n = 5)。
統計學顯著性標記:
- *p < 0.05
- **p < 0.01
- ***p < 0.001
非酒精性脂肪肝(NAFLD)小鼠模型成功通過高脂飲食餵養 12 週誘導建立。不同組別的小鼠每週的體重變化率結果(圖 1B)顯示,小鼠體重逐漸增加,在實驗初期,各組之間的體重增長無顯著差異。然而,從第 8 週開始,相較於高脂飲食組(HFD),維生素 K2 干預組小鼠的體重增長趨勢減緩,甚至出現下降。經過 12 週的餵養後,與空白對照組相比,高脂飲食組小鼠的體重顯著增加,增幅約為 1.3 倍。相比之下,維生素 K2 干預組小鼠的體重比高脂飲食組顯著減少約 1/4(圖 1C)。
小鼠腹圍變化結果如圖 1D 所示,高脂飲食組的腹圍顯著增加,而維生素 K2 干預組的小鼠從第 8 週起腹圍保持相對穩定。各組小鼠的食物攝取量無顯著變化(圖 1E),但高脂飲食組的小鼠飲水量顯著高於對照組(p = 0.0006,圖 1F)。經維生素 K2 干預後,小鼠的飲水量顯著下降。
維生素 K2 對 12 週後小鼠體組成的影響
小鼠體組成分析結果(圖 2A)顯示,與對照組相比,高脂飲食組小鼠的體脂重量顯著增加約 3 倍(C vs HFD: p = 0.0005)。與高脂飲食組相比,維生素 K2 干預組的體脂重量顯著減少約 2 倍:
- HFD vs HFD + VK2(L): p = ns
- HFD vs HFD + VK2(M): p = 0.0014
- HFD vs HFD + VK2(H): p = 0.0081
相同趨勢也可從體脂百分比的統計結果(圖 2B)中觀察到。與對照組相比,高脂飲食組小鼠的體脂百分比增加約 1.7 倍(C vs HFD: p = 0.0003);相比於高脂飲食組,維生素 K2 干預組的體脂百分比降低約 2.3 倍:
- HFD vs HFD + VK2(L): p = 0.0287
- HFD vs HFD + VK2(M): p = 0.0010
- HFD vs HFD + VK2(H): p = 0.0041
然而,維生素 K2 干預組與高脂飲食組之間體液與瘦體質量無顯著差異(圖 2C 和 2D)。這些結果表明,維生素 K2 在減少脂肪積累方面具有顯著效果,且不影響瘦體質量與體液的分佈。
圖2
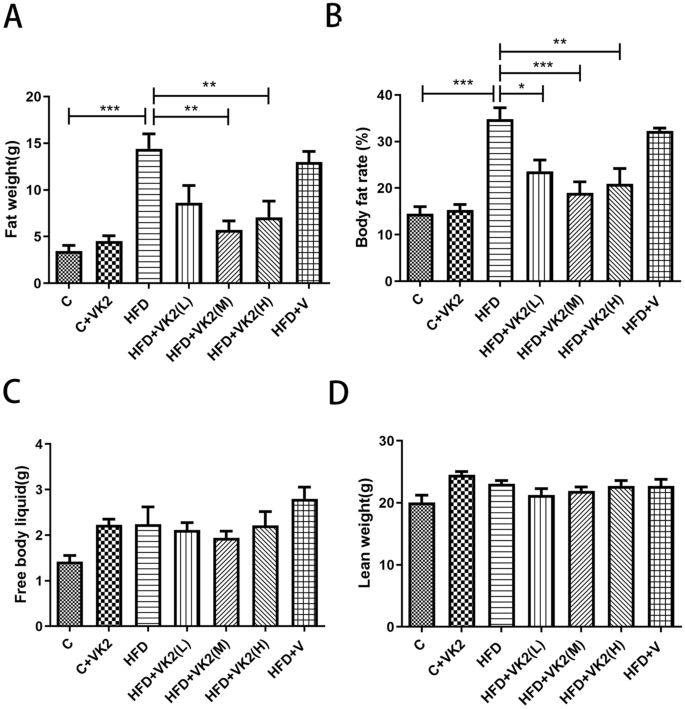
維生素 K2 對 12 週後小鼠外觀及體組成的影響
- (A) 高脂飲食小鼠 體脂重量 變化(餵養 12 週後)
- (B) 高脂飲食小鼠 體脂率 變化(餵養 12 週後)
- (C) 高脂飲食小鼠 自由體液重量 變化(餵養 12 週後)
- (D) 高脂飲食小鼠 瘦體質量 變化(餵養 12 週後)
圖例中的縮寫說明:
- C:對照組(Control group)
- C + VK2:對照 + 維生素 K2 組(Control + Vitamin K2 group)
- HFD:高脂飲食組(High-fat diet group)
- HFD + VK2(L):高脂飲食 + 0.1 mg/kg 維生素 K2 組
- HFD + VK2(M):高脂飲食 + 0.2 mg/kg 維生素 K2 組
- HFD + VK2(H):高脂飲食 + 0.4 mg/kg 維生素 K2 組
- HFD + V:高脂飲食 + 載體對照組
數據表示方式:
- 所有數據均以 均值 ± 標準誤(SEM) 表示(n = 5)
- 統計學顯著性標記:
- *p < 0.05
- **p < 0.01
- ***p < 0.001
上述結果表明,非酒精性脂肪肝(NAFLD)小鼠模型已成功建立,並且維生素 K2 干預可能對該模型產生積極影響。
維生素 K2 對肝臟的影響
肝臟的外觀變化顯示於補充圖 S1,肝臟標本、肝濕重及肝指數(肝重與體重比值)結果如圖 3 所示。
透過視覺觀察,小鼠肝臟顯示出明顯的變化。高脂飲食(HFD)組的小鼠肝臟明顯較大、表面更光滑且顏色較淡,相比之下,維生素 K2 干預組的小鼠肝臟顏色較為紅潤(圖 3A,補充圖 S1)。
小鼠肝臟重量統計結果顯示(圖 3B),與對照組相比,高脂飲食組的小鼠肝濕重顯著增加約 2.8 倍(C vs HFD: p < 0.0001)。相比之下,維生素 K2 干預組的小鼠肝濕重顯著降低約 2.7 倍:
- HFD vs HFD + VK2(L): p = 0.0001
- HFD vs HFD + VK2(M): p < 0.0001
- HFD vs HFD + VK2(H): p < 0.0001
此外,小鼠肝指數分析(圖 3C)顯示,與高脂飲食組相比,維生素 K2 干預組的肝指數顯著降低約 1.6 倍:
- HFD vs HFD + VK2(L): p = 0.0222
- HFD vs HFD + VK2(M): p = 0.0038
這些結果表明,維生素 K2 可有效改善肝臟的宏觀損傷。
圖3
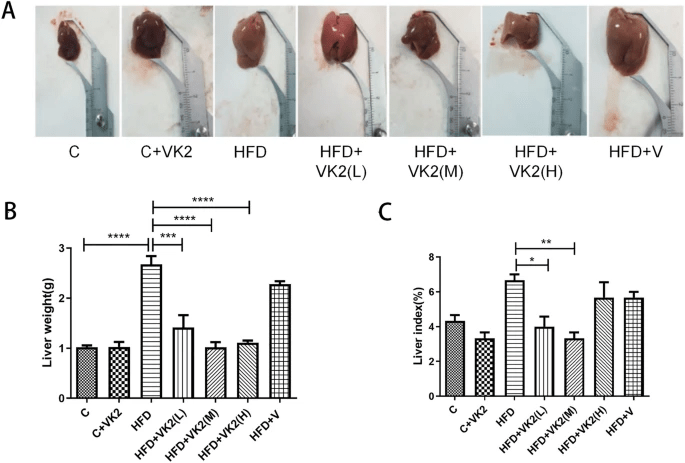
維生素 K2 干預對 NAFLD 小鼠的影響
前述結果表明 非酒精性脂肪肝(NAFLD)小鼠模型成功建立,並且 維生素 K2 介入可能對 NAFLD 具有積極影響。
維生素 K2 對肝臟的影響
- 肝臟的外觀變化 顯示於 補充圖 S1。
- 肝臟標本、肝濕重及肝指數(肝重/體重比值) 如 圖 3 所示。
1. 肝臟外觀變化
- HFD 組 小鼠的 肝臟體積明顯增大,表面較光滑且顏色偏淡,顯示典型的脂肪變性特徵。
- 維生素 K2 干預組的小鼠肝臟顏色較紅潤,顯示出相對健康的狀態(圖 3A,補充圖 S1)。
2. 肝濕重(Liver Wet Weight)
- 統計結果(圖 3B) 顯示:
- HFD 組小鼠的 肝濕重比對照組增加約 2.8 倍(C vs HFD: p < 0.0001)。
- 維生素 K2 干預後,肝濕重顯著降低約 2.7 倍:
- HFD vs HFD + VK2(L): p = 0.0001
- HFD vs HFD + VK2(M): p < 0.0001
- HFD vs HFD + VK2(H): p < 0.0001
3. 肝指數(Liver Index, 肝重/體重比值)
- 統計結果(圖 3C) 顯示:
- 與 HFD 組相比,維生素 K2 干預組的肝指數顯著下降約 1.6 倍:
- HFD vs HFD + VK2(L): p = 0.0222
- HFD vs HFD + VK2(M): p = 0.0038
維生素 K2 對附睪周圍脂肪重量的影響
小鼠附睪周圍的脂肪變化如圖 4A 所示。附睪周圍脂肪(Periepididymal fat)可反映小鼠內臟脂肪的水平。
在小鼠附睪周圍脂肪的統計結果中(圖 4B),與對照組相比,高脂飲食組(HFD)小鼠的附睪周圍脂肪積累及脂肪重量顯著增加約 6 倍(C vs HFD: p < 0.0001)。相比之下,維生素 K2 干預組顯著減少附睪周圍脂肪積累及脂肪重量,降低約 2–3 倍:
- HFD vs HFD + VK2(L): p < 0.0001
- HFD vs HFD + VK2(M): p < 0.0001
- HFD vs HFD + VK2(H): p < 0.0001
圖4
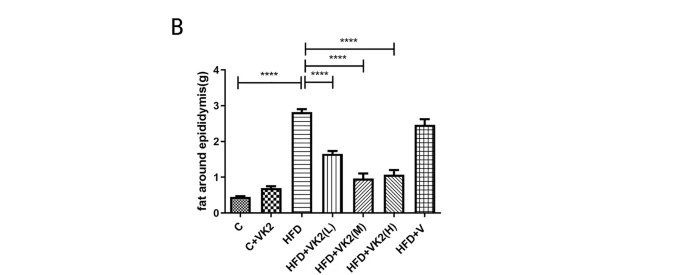
維生素 K2 對附睪周圍脂肪重量的影響
- 圖 4A 顯示了小鼠 附睪周圍脂肪 的視覺變化。
- 附睪周圍脂肪(Periepididymal fat)是 衡量小鼠內臟脂肪水平的重要指標。
1. 附睪周圍脂肪重量統計分析
- 統計結果(圖 4B) 顯示:
- 與對照組相比,高脂飲食組(HFD)小鼠的附睪周圍脂肪顯著增加約 6 倍(C vs HFD: p < 0.0001)。
- 與 HFD 組相比,維生素 K2 干預組的小鼠附睪周圍脂肪積累顯著減少 2–3 倍:
- HFD vs HFD + VK2(L): p < 0.0001
- HFD vs HFD + VK2(M): p < 0.0001
- HFD vs HFD + VK2(H): p < 0.0001
不同劑量的維生素 K2 對附睪周圍脂肪的影響
- (A) 維生素 K2 對 高脂飲食小鼠附睪周圍脂肪外觀 的影響
- (B) 維生素 K2 對 高脂飲食小鼠附睪周圍脂肪重量 的影響
圖例中的縮寫說明
- C:對照組(Control group)
- C + VK2:對照 + 維生素 K2 組(Control + Vitamin K2 group)
- HFD:高脂飲食組(High-fat diet group)
- HFD + VK2(L):高脂飲食 + 0.1 mg/kg 維生素 K2 組
- HFD + VK2(M):高脂飲食 + 0.2 mg/kg 維生素 K2 組
- HFD + VK2(H):高脂飲食 + 0.4 mg/kg 維生素 K2 組
- HFD + V:高脂飲食 + 載體對照組
數據表示方式
- 所有數據以 均值 ± 標準誤(SEM) 表示(n = 5)
- 統計學顯著性標記:
- ****p < 0.0001(高度顯著)
這些結果表明,維生素 K2 可能通過減少內臟脂肪負擔來保護小鼠免受非酒精性肝損傷的影響。
維生素 K2 對肝組織學的影響
在光學顯微鏡下觀察(圖 5A),對照組(C)和對照 + 維生素 K2 組(C + VK2)的小鼠肝索、肝小葉、中心靜脈及門脈區結構清晰可見。肝細胞完整且呈圓形,細胞核大、圓、居中,染色質豐富。
高脂飲食組(HFD)及高脂飲食 + 載體對照組(HFD + V)均出現明顯的大泡性脂肪變性,主要位於中央小葉門脈區,並伴隨肝細胞氣球樣變性(顏色明顯變淺)。肝小葉結構模糊,中心靜脈邊緣不均勻,細胞核受到擠壓偏向一側,並伴隨炎症及纖維增生。
然而,在維生素 K2 干預組,肝脂肪變性明顯減少,且觀察到新生的正常肝細胞形成。
通過分析各組小鼠肝組織的脂肪變性程度(圖 5B),與對照組相比,高脂飲食組小鼠出現顯著的脂肪變性,約為對照組的 4 倍(C vs HFD: p < 0.0001)。與高脂飲食組相比,維生素 K2 干預組小鼠的脂肪變性程度顯著減少 2 倍:
- HFD vs HFD + VK2(L): p = 0.0001
- HFD vs HFD + VK2(M): p < 0.0001
- HFD vs HFD + VK2(H): p = 0.0001
圖5
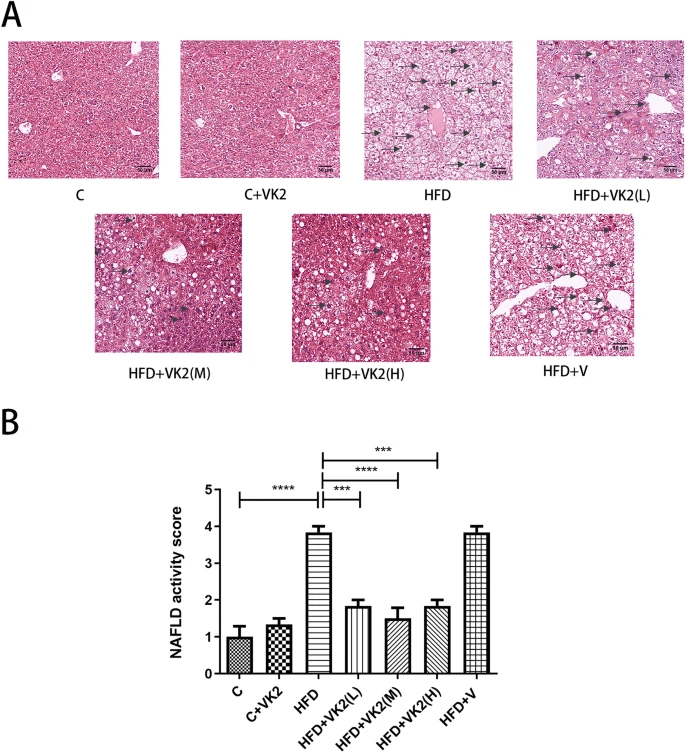
維生素 K2 對肝組織學的影響
(A) 肝組織學特徵觀察
- 光學顯微鏡(200X,比例尺:50 μm) 下觀察各組小鼠肝臟組織特徵。
- 箭頭標示 了 脂肪變性(steatosis)、炎症(inflammation)及纖維化(fibrosis) 的位置。
- 切片經蘇木精 & 伊紅(H&E)染色,清晰顯示各組肝組織變化。
(B) 肝臟脂肪變性評分
- 統計結果 顯示:
- 高脂飲食組(HFD)小鼠的肝脂肪變性程度顯著高於對照組。
- 維生素 K2 干預後,脂肪變性程度顯著下降,表明其對 NAFLD 具有保護作用。
圖例中的縮寫說明
- C:對照組(Control group)
- C + VK2:對照 + 維生素 K2 組(Control + Vitamin K2 group)
- HFD:高脂飲食組(High-fat diet group)
- HFD + VK2(L):高脂飲食 + 0.1 mg/kg 維生素 K2 組
- HFD + VK2(M):高脂飲食 + 0.2 mg/kg 維生素 K2 組
- HFD + VK2(H):高脂飲食 + 0.4 mg/kg 維生素 K2 組
- HFD + V:高脂飲食 + 載體對照組
數據表示方式
- 數據以均值 ± 標準誤(SEM)表示(n = 5)
- 統計學顯著性標記:
- ***p < 0.001(顯著)
- ****p < 0.0001(高度顯著)
結果顯示,維生素 K2 能夠預防小鼠肝組織的病理變化。
維生素 K2 對血清學指標的影響
基於先前的實驗,我們成功建立了 NAFLD 小鼠模型,並初步驗證了維生素 K2 對 高脂飲食誘導的 NAFLD 具有積極影響。此外,研究結果顯示,最佳治療劑量為 0.2 mg/kg(HFD + VK2(M))。
3-羥基-3-甲基戊二酸單酰輔酶 A 還原酶(HMGR) 是 膽固醇合成的關鍵限速酶。研究結果表明,高脂飲食組小鼠的 HMGR 水平比對照組顯著升高 1.6 倍(C vs HFD: p = 0.005)。然而,在 維生素 K2 干預後,HMGR 水平顯著下降 32%(HFD vs HFD + VK2(M): p = 0.0338)(圖 6A)
圖6
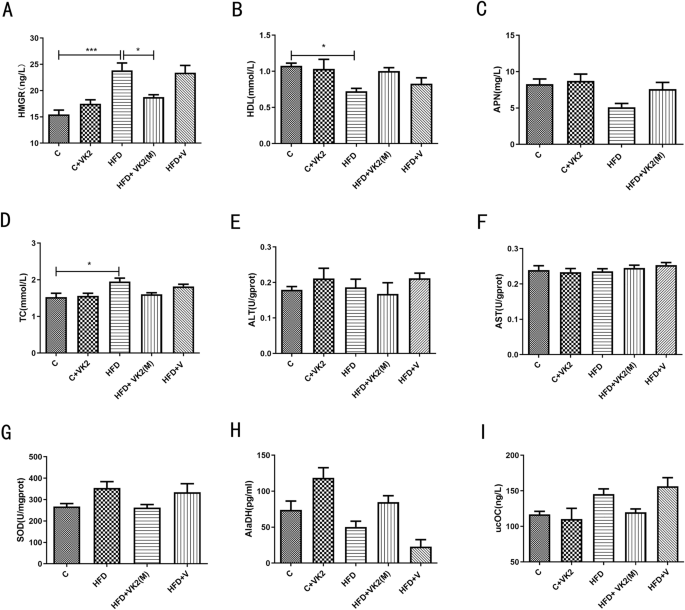
維生素 K2 對高脂飲食小鼠的血清學指標、肝毒性及其他生化指標的影響
本研究進一步分析 維生素 K2 對高脂飲食(HFD)小鼠的血清學指標與肝功能指標的影響。
(A) HMGR(血清中 HMG-CoA 還原酶水平)
- HMG-CoA 還原酶(HMGR)是 膽固醇合成的關鍵限速酶,其升高與 NAFLD 相關。
- 高脂飲食顯著增加 HMGR 水平,而 維生素 K2 干預後顯著抑制 HMGR 活性。
(B) HDL(血清高密度脂蛋白)
- 高密度脂蛋白(HDL)被認為是 “好膽固醇”,有助於 膽固醇逆向運輸,減少動脈粥狀硬化風險。
- 維生素 K2 干預可能有助於提升 HDL 水平,改善脂質代謝。
(C) APN(血清脂聯素)
- 脂聯素(Adiponectin, APN)是 脂肪組織分泌的活性蛋白,可改善 胰島素敏感性與脂質代謝。
- 維生素 K2 干預對 APN 水平的影響需進一步研究。
(D) TC(血清總膽固醇)
- 高脂飲食組(HFD)小鼠的總膽固醇(TC)水平顯著升高。
- 維生素 K2 干預可調節 TC 水平,可能有助於改善脂肪代謝。
(E) ALT(血清丙氨酸轉氨酶)與 (F) AST(血清天冬氨酸轉氨酶)
- ALT 和 AST 是 肝細胞損傷的重要指標:
- ALT(Alanine aminotransferase) 主要存在於 肝細胞,當肝細胞受損時,ALT 會釋放至血液中。
- AST(Aspartate aminotransferase) 可來自 肝臟、心臟與肌肉,其升高可能反映更廣泛的組織損傷。
- 高脂飲食導致 ALT 與 AST 顯著升高,表明肝損傷。
- 維生素 K2 干預可能對肝細胞具有保護作用,減少 ALT 與 AST 的升高。
(G) SOD(超氧化物歧化酶)
- SOD 是抗氧化酶,可清除自由基,減少氧化應激對肝臟的損傷。
- 維生素 K2 干預是否提升 SOD 活性,仍需進一步研究。
(H) AlaDH(丙氨酸脫氫酶)
- 丙氨酸脫氫酶(AlaDH)參與氨基酸代謝,與肝臟功能有關。
- 維生素 K2 對 AlaDH 的影響需進一步研究。
(I) UcOC(未羧化骨鈣素)
- UcOC 是維生素 K 相關的生物標誌物,與鈣代謝和骨骼健康相關。
- 維生素 K2 可能影響 UcOC 水平,進而影響脂肪與能量代謝。
圖例中的縮寫說明
- C:對照組(Control group)
- C + VK2:對照 + 維生素 K2 組(Control + Vitamin K2 group)
- HFD:高脂飲食組(High-fat diet group)
- HFD + VK2(L):高脂飲食 + 0.1 mg/kg 維生素 K2 組
- HFD + VK2(M):高脂飲食 + 0.2 mg/kg 維生素 K2 組
- HFD + VK2(H):高脂飲食 + 0.4 mg/kg 維生素 K2 組
- HFD + V:高脂飲食 + 載體對照組
數據表示方式
- 數據以均值 ± 標準誤(SEM)表示(n = 4)
- 統計學顯著性標記:
- *p < 0.05(顯著)
- ***p < 0.001(高度顯著)
由於 NAFLD 的主要特徵之一是脂質代謝紊亂[21],因此特別檢測了脂質相關指標。總膽固醇(TC) 和 高密度脂蛋白(HDL) 是臨床上重要的血脂指標[22]。結果顯示,高脂飲食組(HFD)的小鼠 TC 水準顯著高於對照組(p = 0.0141),而 HDL 水準則顯著降低(p = 0.0235)。在接受維生素 K2 干預後,TC 和 HDL 水準無明顯變化(圖 6B 和 6D)。
脂聯素(APN) 是由脂肪組織主要分泌的一種蛋白激素和脂肪因子,能夠調節多種代謝過程,並可用於預測 2 型糖尿病的早期風險[23]。然而,在本實驗中,APN 水準未出現顯著變化(圖 6C)。
上述數據表明,在 NAFLD 小鼠模型中,脂質水準和脂質代謝相關指標(HMGR)發生了顯著變化,這表明 維生素 K2 可能改善脂質代謝紊亂。
維生素 K2 對肝毒性、氧化壓力及線粒體功能的影響
肝毒性 可能發生於 肝細胞脂肪變性 的基礎上。AST(天冬氨酸轉氨酶) 和 ALT(丙氨酸轉氨酶) 是評估肝毒性損傷的經典指標[24]。然而,實驗結果顯示,餵養高脂飲食 3 個月的小鼠並未表現出顯著的肝損傷。此外,無論是單獨補充維生素 K2,還是與高脂飲食聯合使用,均未顯示出顯著的肝毒性(圖 6E 和 6F)。
氧化壓力 是 NAFLD 進展與肝損傷的重要原因。超氧化物歧化酶(SOD) 是衡量氧化壓力抗氧化水準的重要酶[25]。然而,圖 6G 顯示,在本實驗中,各組小鼠的肝組織內 SOD 水準無顯著變化。
線粒體穩態 在細胞能量代謝與信號通路調節中起決定性作用。線粒體穩態失衡是 NAFLD 和肥胖等代謝性疾病的關鍵病理原因[26]。丙氨酸脫氫酶(AlaDH) 與線粒體氧化呼吸鏈功能呈正相關[27]。各組小鼠的 AlaDH 水準結果如圖 6H 所示,然而,在本實驗中,AlaDH 水準在各組間無顯著變化。
血清未羧化骨鈣素(ucOC)水準
骨鈣素(Osteocalcin, OC) 參與 糖脂代謝與能量代謝調節,並可能與 冠心病及 NAFLD 相關[28,29]。羧化作用是骨鈣素發揮功能的重要過程。圖 6I 顯示了各組小鼠的 血清 ucOC 水準。
HFD 組的小鼠 ucOC 水準高於對照組,這表明 HFD 組的小鼠可能由於維生素 K 水準較低,導致骨鈣素羧化不足。然而,在本實驗中,各組間 ucOC 水準無顯著變化,因此,維生素 K2 可能並未通過骨鈣素羧化作用減少 NAFLD 損傷。
討論(Discussion)
全球 NAFLD 的盛行率高達 25%,已成為 全球肝病的重要病因,因此,NAFLD 值得全球醫學工作者的高度關注。
本研究結果表明,維生素 K2 對高脂飲食誘導的 NAFLD 具有保護作用。本研究中,三種不同劑量的維生素 K2 預防性干預 均能有效 延緩小鼠體重與腹圍的增加(圖 1B 和 1D)。Dam 等人[30] 進行了一項對 802 名成年人的 10 年追蹤研究,發現 維生素 K2 攝入量較高者,其腰圍較小,且代謝症候群的發生率較低。此外,有研究報導 人類血漿維生素 K2 水準與體重指數(BMI)呈負相關[31]。
我們發現,接受 維生素 K2 補充的小鼠,其體脂重量與體脂百分比(圖 2A 和 2B) 與 NAFLD 小鼠在第 12 週時呈現顯著差異。具體而言,維生素 K2 可顯著抑制高脂飲食誘導的小鼠體脂與體脂率增加,其中 0.2 mg/kg 的干預效果最佳。值得注意的是,維生素 K2 可調節體內脂肪代謝,且不影響其他身體組成成分的消耗或分佈,如瘦體質量與自由體液(圖 2C 和 2D)。這些結果表明,維生素 K2 是一種安全有效的營養素,可用於減少 NAFLD 伴隨的肥胖及體重增加。
本研究結果顯示,NAFLD 小鼠體型更大,且顯著肥胖,而接受維生素 K2 干預的小鼠則可有效控制體型(圖 1A)。此外,我們發現,預防性補充維生素 K2 不僅減少了肉眼可見的肝臟脂肪變性,還顯著降低了內臟脂肪積累(圖 4)。一項隨機對照試驗(RCT)證實了我們的發現,即 高維生素 K2 攝取有助於降低體重、腹部脂肪與內臟脂肪,尤其在絕經後女性中效果顯著。
維生素 K2 在 NAFLD 肝臟病理學中的保護作用
維生素 K2 在 NAFLD 的肝臟組織學檢查(圖 5) 中表現出 顯著的保護作用。在 NAFLD 組,光學顯微鏡下可見 大範圍的肝脂肪變性,主要位於 中央肝小葉門脈區,並伴隨 炎症反應及纖維增生。Salw 等人[32] 研究表明,高脂飲食誘導的 NAFLD 小鼠,其肝組織病理變化會隨時間逐漸加重。
然而,本研究中,AST 和 ALT 的檢測結果(圖 6E 和 6F)顯示,小鼠未出現明顯的炎症傾向。換句話說,在 輕度 NAFLD 中,脂肪主要儲存於細胞質內,並不一定會入侵其他細胞器,導致顯著的炎症變化。
在所有 維生素 K2 干預組中,NAFLD + VK2(M) 組的變化最為顯著。肝炎症明顯減少,脂肪小滴較小且分散,且未觀察到明顯的纖維化區域。這些結果表明,維生素 K2 可從組織學層面降低肝臟脂肪積累,並對 NAFLD 具有一定的預防與逆轉作用。
維生素 K2 對血脂代謝紊亂的影響
本研究發現,NAFLD 小鼠出現血脂異常,表現為 血清 TC 水準增加,HDL 水準降低(圖 6D 和 6B)。肝內三酸甘油酯(TG)積累 是 肝脂肪變性的標誌,並可能與 氧化壓力及炎症共同促成 NAFLD 的發生[33]。值得注意的是,NAFLD 相關的動脈粥樣硬化型血脂異常,還可能增加心血管疾病風險[34]。
然而,本研究結果顯示,維生素 K2 無法糾正 NAFLD 小鼠的血脂異常。此外,在 NAFLD 中,膽固醇合成顯著增強,研究表明 HMGR(膽固醇合成的限速酶)在 NAFLD 和 NASH 患者中的表達顯著增加,且與是否肥胖無關[35]。此外,HMGR 的高表達與肝內游離膽固醇水準及 NAFLD 活性指數密切相關[35]。本研究發現 維生素 K2 干預後,HMGR 水準顯著降低(圖 6A),顯示 維生素 K2 可能參與膽固醇代謝的調節。
APN 是由脂肪細胞分泌的最豐富的細胞激素之一。APN 可通過肝臟受體與磷酸酪氨酸適配蛋白相互作用,進一步激活多條訊號通路[36]。例如,APN 可激活 5′-腺苷酸單磷酸活化蛋白激酶(AMPK)與過氧化物酶體增殖子活化受體 α(PPAR-α)訊號通路,以減少脂肪酸合成並促進脂肪酸氧化,從而抑制肝脂肪積累[37]。
值得注意的是,APN 亦可顯著提升血清 HDL 水準並增加胰島素敏感性[37]。最近,一項 隨機安慰劑對照試驗(RCT)顯示,在 148 名絕經後女性中,長期補充 MK-7 可顯著提高 APN 水準[38]。然而,本研究結果顯示,各組小鼠的 APN 水準無顯著變化(圖 6C),這可能表明 APN 不是維生素 K2 干預 NAFLD 的主要機制。
研究局限性與未來方向
雖然本研究從多個方面探討了 維生素 K2 在 NAFLD 中的作用機制,但最終結果仍較為有限,這也是本實驗的局限性。從實驗設計來看,儘管本研究的最終目標是探討 維生素 K2 在 NAFLD 分子機制中的作用,但目前的實驗結果僅能證明 維生素 K2 在體內可有效治療 NAFLD,而尚未深入解析其作用機制。
未來研究方向包括:
- 最佳干預劑量仍為中等劑量,而非最高劑量,不符合劑量依賴性原則,需進一步探索。
- 本研究缺乏體外實驗,無法探討 K2 在細胞內的直接作用機制。
- 維生素 K2 可能透過三種主要途徑發揮作用,包括激活線粒體功能[41]、促進維生素 K 依賴蛋白的羧化[45],以及抑制鐵死亡(ferroptosis)[46],未來應進一步研究其與 NAFLD 既有或未知靶點的關聯性。
結論(Conclusion)
本研究結果表明,維生素 K2 對高脂飲食誘導的非酒精性脂肪肝(NAFLD)具有顯著的保護作用。
維生素 K2 能夠顯著降低 NAFLD 小鼠的體脂含量,但不影響其他身體組成成分的分佈,如瘦體質量與體液。此外,維生素 K2 可有效改善肝臟組織的病理變化,減少脂肪變性與內臟脂肪積累,對 NAFLD 具有一定的預防與逆轉作用。
在血脂代謝方面,維生素 K2 未能改善 NAFLD 小鼠的血脂異常(總膽固醇 TC、高密度脂蛋白 HDL),但能修正膽固醇代謝紊亂。與高脂飲食組相比,K2 介入後 HMGR 水平顯著下降,表明維生素 K2 可能通過調節膽固醇合成途徑發揮作用。
在其他代謝指標方面,本研究未發現維生素 K2 對脂聯素(APN)產生明顯影響,顯示 APN 可能不是 K2 調控 NAFLD 的主要機制。此外,線粒體功能指標 AlaDH 及抗氧化壓力指標 SOD 在各組間無顯著變化,顯示 K2 可能未對這些機制產生明顯作用。此外,K2 介入後未能顯著改變 ucOC(未羧化骨鈣素)水平,表明其在本研究條件下,對骨鈣素調控脂肪代謝的影響較為有限。
總體而言,維生素 K2 有助於預防 NAFLD 的發生,並延緩 NAFLD 的進展,為其作為 NAFLD 的潛在治療策略提供了新證據。然而,維生素 K2 的具體作用機制仍需進一步研究,以確定其影響 NAFLD 的潛在分子機制。
參考文獻
- Younossi, Z. et al. Global burden of NAFLD and NASH: Trends, predictions, risk factors and prevention. Nat. Rev. Gastroenterol. Hepatol. 15, 11–20. https://doi.org/10.1038/nrgastro.2017.109 (2018).Article PubMed Google Scholar
- European Association for the Study of the, L., European Association for the Study of, D. & European Association for the Study of, O. EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. J. Hepatol. 64, 1388–1402. https://doi.org/10.1016/j.jhep.2015.11.004 (2016).
- Leoni, S. et al. Current guidelines for the management of non-alcoholic fatty liver disease: A systematic review with comparative analysis. World J. Gastroenterol. 24, 3361–3373. https://doi.org/10.3748/wjg.v24.i30.3361 (2018).Article PubMed PubMed Central Google Scholar
- Yki-Järvinen, H. Non-alcoholic fatty liver disease as a cause and a consequence of metabolic syndrome. Lancet Diabetes Endocrinol. 2, 901–910. https://doi.org/10.1016/s2213-8587(14)70032-4 (2014).Article PubMed Google Scholar
- Tanaka, N. et al. Clinical characteristics of de novo nonalcoholic fatty liver disease following pancreaticoduodenectomy. J. Gastroenterol. 46, 758–768. https://doi.org/10.1007/s00535-011-0370-5 (2011).Article CAS PubMed ADS Google Scholar
- Romero-Gómez, M., Zelber-Sagi, S. & Trenell, M. Treatment of NAFLD with diet, physical activity and exercise. J. Hepatol. 67, 829–846. https://doi.org/10.1016/j.jhep.2017.05.016 (2017).Article PubMed Google Scholar
- Bril, F. et al. Role of vitamin E for nonalcoholic steatohepatitis in patients with Type 2 diabetes: A randomized controlled trial. Diabetes Care 42, 1481–1488. https://doi.org/10.2337/dc19-0167 (2019).Article CAS PubMed Google Scholar
- Villa, J. K. D., Diaz, M. A. N., Pizziolo, V. R. & Martino, H. S. D. Effect of vitamin K in bone metabolism and vascular calcification: A review of mechanisms of action and evidences. Crit. Rev. Food Sci. Nutr. 57, 3959–3970. https://doi.org/10.1080/10408398.2016.1211616 (2017).Article CAS PubMed Google Scholar
- Lasemi, R., Kundi, M., Moghadam, N. B., Moshammer, H. & Hainfellner, J. A. Vitamin K2 in multiple sclerosis patients. Wiener klinische Wochenschrift 130, 307–313. https://doi.org/10.1007/s00508-018-1328-x (2018).Article CAS PubMed PubMed Central Google Scholar
- Schurgers, L. et al. Vitamin K-containing dietary supplements: comparison of synthetic vitamin K1 and natto-derived menaquinone-7. Blood 109, 3279–3283. https://doi.org/10.1182/blood-2006-08-040709 (2007).Article CAS PubMed Google Scholar
- Tsugawa, N. et al. Vitamin K status of healthy Japanese women: age-related vitamin K requirement for gamma-carboxylation of osteocalcin. Am. J. Clin. Nutr. 83, 380–386. https://doi.org/10.1093/ajcn/83.2.380 (2006).Article CAS PubMed Google Scholar
- Qiu, C. et al. Vitamin K2 inhibits rat vascular smooth muscle cell calcification by restoring the Gas6/Axl/Akt anti-apoptotic pathway. Mol. Cell. Biochem. 433, 149–159. https://doi.org/10.1007/s11010-017-3023-z (2017).Article CAS PubMed Google Scholar
- Misra, D. et al. Vitamin K deficiency is associated with incident knee osteoarthritis. Am. J. Med. 126, 243–248. https://doi.org/10.1016/j.amjmed.2012.10.011 (2013).Article CAS PubMed PubMed Central Google Scholar
- Kimur, I., Tanizaki, Y., Sato, S., Saito, K. & Takahashi, K. Menaquinone (vitamin K2) therapy for bronchial asthma. II. Clinical effect of menaquinone on bronchial asthma. Acta Med. Okayama 29, 127–135 (1975).CAS PubMed Google Scholar
- Tarkesh, F., Namavar Jahromi, B., Hejazi, N. & Tabatabaee, H. Beneficial health effects of menaquinone-7 on body composition, glycemic indices, lipid profile, and endocrine markers in polycystic ovary syndrome patients. Food Sci. Nutr. 8, 5612–5621. https://doi.org/10.1002/fsn3.1837 (2020).Article CAS PubMed PubMed Central Google Scholar
- Rahimi Sakak, F., Moslehi, N., Niroomand, M. & Mirmiran, P. Glycemic control improvement in individuals with type 2 diabetes with vitamin K supplementation: A randomized controlled trial. Eur. J. Nutr. https://doi.org/10.1007/s00394-020-02419-6 (2020).Article PubMed Google Scholar
- Han, J. M. et al. Associations between intakes of individual nutrients or whole food groups and non-alcoholic fatty liver disease among Korean adults. J. Gastroenterol. Hepatol. 29, 1265–1272. https://doi.org/10.1111/jgh.12520 (2014).Article CAS PubMed Google Scholar
- Lin, M. et al. Vitamin K2-enhanced liver regeneration is associated with oval cell expansion and up-regulation of matrilin-2 expression in 2-AAF/PH rat model. Curr. Mol. Med. 14, 361–369. https://doi.org/10.2174/1566524013666131118113017 (2014).Article CAS PubMed Google Scholar
- Licata, A. et al. The role of vitamin deficiency in liver disease: To supplement or not supplement?. Nutrients https://doi.org/10.3390/nu13114014 (2021).Article PubMed PubMed Central Google Scholar
- Wang, Y. et al. Vitamin K2 (MK-7) attenuates LPS-induced acute lung injury via inhibiting inflammation, apoptosis, and ferroptosis. PLoS One 18, e0294763. https://doi.org/10.1371/journal.pone.0294763 (2023).Article CAS PubMed PubMed Central Google Scholar
- Heeren, J. & Scheja, L. Metabolic-associated fatty liver disease and lipoprotein metabolism. Mol. Metab. 50, 101238. https://doi.org/10.1016/j.molmet.2021.101238 (2021).Article CAS PubMed PubMed Central Google Scholar
- Kan, B. et al. Association between lipid biomarkers and osteoporosis: A cross-sectional study. BMC Musculoskelet. Disord. 22, 759. https://doi.org/10.1186/s12891-021-04643-5 (2021).Article CAS PubMed PubMed Central Google Scholar
- Beige, J., Heipmann, K., Stumvoll, M., Körner, A. & Kratzsch, J. Paradoxical role for adiponectin in chronic renal diseases? An example of reverse epidemiology. Expert Opin. Ther. Targets 13, 163–173. https://doi.org/10.1517/14728220802658481 (2009).Article CAS PubMed Google Scholar
- Aljobaily, N. et al. Creatine alleviates doxorubicin-induced liver damage by inhibiting liver fibrosis, inflammation, oxidative stress, and cellular senescence. Nutrients https://doi.org/10.3390/nu13010041 (2020).Article PubMed PubMed Central Google Scholar
- Guerreiro, A. D. S., Abreu, F. E. L., Fillmann, G. & Sandrini, J. Z. Effects of chlorothalonil on the antioxidant defense system of mussels Perna perna. Ecotoxicol. Environ. Saf. 190, 110119. https://doi.org/10.1016/j.ecoenv.2019.110119 (2020).Article CAS PubMed Google Scholar
- Guha, S., Sesili, S., Mir, I. H. & Thirunavukkarasu, C. Epigenetics and mitochondrial dysfunction insights into the impact of the progression of non-alcoholic fatty liver disease. Cell Biochem. Funct. 41, 4–19. https://doi.org/10.1002/cbf.3763 (2023).Article CAS PubMed Google Scholar
- Dave, U. C. & Kadeppagari, R. K. Alanine dehydrogenase and its applications-A review. Crit. Rev. Biotechnol. 39, 648–664. https://doi.org/10.1080/07388551.2019.1594153 (2019).Article CAS PubMed Google Scholar
- Zhang, Y. et al. Relation of serum osteocalcin level to risk of coronary heart disease in Chinese adults. Am. J. Cardiol. 106, 1461–1465. https://doi.org/10.1016/j.amjcard.2010.07.013 (2010).Article CAS PubMed Google Scholar
- Xia, M. et al. Osteocalcin and non-alcoholic fatty liver disease: Lessons from two population-based cohorts and animal models. J. Bone Miner. Res. 36, 712–728. https://doi.org/10.1002/jbmr.4227 (2021).Article CAS PubMed Google Scholar
- Dam, V. et al. Association between vitamin K and the metabolic syndrome: A 10-year follow-up study in adults. J. Clin. Endocrinol. Metab. 100, 2472–2479. https://doi.org/10.1210/jc.2014-4449 (2015).Article CAS PubMed Google Scholar
- Ravera, M. et al. Overweight-obesity is associated with decreased vitamin K2 levels in hemodialysis patients. Clin. Chem. Lab. Med. 59, 581–589. https://doi.org/10.1515/cclm-2020-0194 (2021).Article CAS PubMed Google Scholar
- Abo El-Khair, S., Ghoneim, F., Shabaan, D. & Elsamanoudy, A. Molecular and ultrastructure study of endoplasmic reticulum stress in hepatic steatosis: Role of hepatocyte nuclear factor 4α and inflammatory mediators. Histochem. Cell Biol. 153, 49–62. https://doi.org/10.1007/s00418-019-01823-2 (2020).Article CAS PubMed Google Scholar
- Faheem, S., Saeed, N., El-Naga, R., Ayoub, I. & Azab, S. Hepatoprotective effect of cranberry nutraceutical extract in non-alcoholic fatty liver model in rats: Impact on insulin resistance and Nrf-2 expression. Front. Pharmacol. 11, 218. https://doi.org/10.3389/fphar.2020.00218 (2020).Article CAS PubMed PubMed Central Google Scholar
- Katsiki, N., Mikhailidis, D. & Mantzoros, C. Non-alcoholic fatty liver disease and dyslipidemia: An update. Metab. Clin. Exp. 65, 1109–1123. https://doi.org/10.1016/j.metabol.2016.05.003 (2016).Article CAS PubMed Google Scholar
- Min, H. et al. Increased hepatic synthesis and dysregulation of cholesterol metabolism is associated with the severity of nonalcoholic fatty liver disease. Cell Metab. 15, 665–674. https://doi.org/10.1016/j.cmet.2012.04.004 (2012).Article CAS PubMed PubMed Central Google Scholar
- Deepa, S. & Dong, L. APPL1: Role in adiponectin signaling and beyond. Am. J. Physiol. Endocrinol. Metab. 296, E22–E36. https://doi.org/10.1152/ajpendo.90731.2008 (2009).Article CAS PubMed Google Scholar
- Shabalala, S. et al. The effect of adiponectin in the pathogenesis of non-alcoholic fatty liver disease (NAFLD) and the potential role of polyphenols in the modulation of adiponectin signaling. Biomed. Pharmacother. Biomed. Pharmacother. 131, 110785. https://doi.org/10.1016/j.biopha.2020.110785 (2020).Article CAS PubMed Google Scholar
- Rønn, S., Harsløf, T., Pedersen, S. & Langdahl, B. Vitamin K2 (menaquinone-7) increases plasma adiponectin but does not affect insulin sensitivity in postmenopausal women: A randomized controlled trial. Eur. J. Clin. Nutr. https://doi.org/10.1038/s41430-021-00884-8 (2021).Article PubMed Google Scholar
- Vervoort, L., Ronden, J. & Thijssen, H. The potent antioxidant activity of the vitamin K cycle in microsomal lipid peroxidation. Biochem. Pharmacol. 54, 871–876. https://doi.org/10.1016/s0006-2952(97)00254-2 (1997).Article CAS PubMed Google Scholar
- Westhofen, P. et al. Human vitamin K 2,3-epoxide reductase complex subunit 1-like 1 (VKORC1L1) mediates vitamin K-dependent intracellular antioxidant function. J. Biol. Chem. 286, 15085–15094. https://doi.org/10.1074/jbc.M110.210971 (2011).Article CAS PubMed PubMed Central Google Scholar
- Vos, M. et al. Vitamin K2 is a mitochondrial electron carrier that rescues pink1 deficiency. Science 336, 1306–1310. https://doi.org/10.1126/science.1218632 (2012).Article CAS PubMed ADS Google Scholar
- Hussein, A., Mohamed, R., Shalaby, S. & Abd El Motteleb, D. Vitamin K alleviates type 2 diabetes in rats by induction of osteocalcin gene expression. Nutrition 47, 33–38. https://doi.org/10.1016/j.nut.2017.09.016 (2018).Article CAS PubMed Google Scholar
- Xia, M. et al. Osteocalcin and non-alcoholic fatty liver disease: lessons from two population-based cohorts and animal models. J. Bone Min. Res. Off. J. Am. Soc. Bone Min. Res. https://doi.org/10.1002/jbmr.4227 (2020).Article Google Scholar
- Otani, T. et al. The roles of osteocalcin in lipid metabolism in adipose tissue and liver. Adv. Biol. Regul. 78, 100752. https://doi.org/10.1016/j.jbior.2020.100752 (2020).Article CAS PubMed Google Scholar
- Halder, M. et al. Vitamin K: Double bonds beyond coagulation insights into differences between vitamin K1 and K2 in health and disease. Int. J. Mol. Sci. https://doi.org/10.3390/ijms20040896 (2019).Article PubMed PubMed Central Google Scholar
- Mishima, E. et al. A non-canonical vitamin K cycle is a potent ferroptosis suppressor. Nature 608, 778–783. https://doi.org/10.1038/s41586-022-05022-3 (2022).Article CAS PubMed PubMed Central ADS Google Scholar