譯者結論:
- 這篇回顧強調了硒蛋白質在男性生育和繁殖中的重要性,並突出了硒和硒蛋白質與整體男性生殖功能相關的生物功能。
- 過去的研究已經顯示,硒對於精子生成和男性生育能力是至關重要的,主要是因為其在抗氧化防禦機制和其他重要的生物途徑中的作用。
- 該文章建議需要進一步研究硒蛋白質的角色,如麩胱甘肽過氧化酶4 (GPX4) 和硒蛋白質P (SELENOP) 在男性生殖功能中的作用。
- 評論的結論是,需要進一步的研究來驗證當前的證據,並探索使用硒補充劑來增強男性生育能力的潛在治療策略。

摘要
硒(Se)是一種重要的微量元素,在動物和人類健康的細胞和有機體層面上都有許多基本的角色。硒的生物效應主要是由硒蛋白(在人類由25個基因編碼,在老鼠中為24個)來執行的。作為硒蛋白的一個基本組成部分,硒執行結構和酶的角色;在後者的上下文中,它以其催化和抗氧化功能而著稱。涉及不同動物模型的研究增強了我們對硒和硒蛋白在哺乳動物生殖和繁殖中的潛在意義的理解。在這篇回顧中,我們強調了硒蛋白在男性生育和繁殖中的意義,隨後是與整體男性生殖功能相關的硒和硒蛋白的特性生物功能。從過去研究(動物和人類)的觀察中可以明確看到,硒對於精子生成和男性生育是必不可少的,這可能是因為它在調節抗氧化防禦機制以及其他基本的生物途徑和與氧化還原敏感的轉錄因子中的重要作用。然而,考慮到主流文獻中的證據,也建議進行更多的研究,以闡明特殊和標準硒蛋白,即葡萄糖醛酸過氧化酶4(GPX4)和硒蛋白P(SELENOP)在男性生殖功能中所起的額外作用。不過,尋找其他與生物相關的硒蛋白可能調節的附加假定機制也應該被包括在未來研究的範疇之內。然而,對於硒在男性的生育和繁殖中的意義,雖然有一些臨床試驗探討了硒補充對男性生殖能力的影響,但由於受試者的招募存在不一致性和設計的異質性,這些研究的比較仍然複雜且不太明確。因此,期待進一步的研究集中於硒和硒蛋白的角色,以驗證手頭的證據,並概述任何旨在提高男性生育能力的治療方案。因此,可以為男性生育和硒補充添加新的維度。
簡介
背景
1817年,Se首次由Jöns Jacob Berzelius確定,當時他正在瑞典一家硫酸工廠進行有關引發工人健康不良爆發的化學物質的調查[1]。直到1950年代,才發現其對動物正常生長和繁殖的基本重要性[2]。然而,Se在人體中的重要性的確切證明,是通過中國的大型試驗的發現,這些試驗顯示了Se補充劑對患有克山病(特點是心肌病變)的兒童和年輕成年人的改善效果;在土壤Se含量低的地區曾是地方性疾病[3,4]。
硒在哺乳動物繁殖中的意義:概述
哺乳動物的最佳繁殖效率取決於許多因素,如遺傳、營養、管理和環境決定因素[5]。其中,微量礦物質營養對於正常生長、發育和繁殖等各種生物功能至關重要[6]。此外,即使是微量元素(如微量礦物質)水平的細微變化,也可能對包括生殖健康和表現在內的重要生物過程產生相當大的影響[5,6]。同樣地,對於硒,其不足與過多之間存在一個明確的界限,其基本和毒性水平均已明確界定[7,8]。為了在細胞內維持最佳的硒濃度,必須有嚴格控制的機制[8]。理想情況下,為了研究硒補充劑是否可以改善生育能力,應該預先定義硒足量/不足的參考範圍[7]。大部分情況下,硒濃度取決於正在分析的組織[7]。事實上,目前還不清楚哪種生物液體,如血液、血清、精漿、精子、卵泡液,能最準確地反映硒濃度與其在繁殖中的作用[7]。顯然,有關血清硒與生殖組織中水平之間的關係的科學資訊仍然匱乏[7]。然而,過去的少數報告在哺乳動物模型上已經展示了硒狀態與雄性[5,9]和雌性[5,10]的生殖表現之間的關係。男性生殖器官中的足夠Se痕量對於正常的精子生成、精子成熟、精子運動和整體功能是必不可少的[11,12,13,14]。增加膳食Se攝取量也已被認為可以增強抗氧化劑葡萄糖醛酸過氧化酶(GPX)的活性,從而提高男性的生育能力[15]。
硒的生化特性與重要性
通常,硒被用於有機或無機形式。以前曾討論過硒的形式對其可能的改善效果和/或對生物體整體健康和發展的不良毒理學後果有重要的影響[8,16,17]。此外,還有人認為硒的形式和總攝取量在潛在的健康相關效果方面同樣重要。但需要強調的是,攝取的硒的形式在此背景下可能更有價值[18]。已有報告顯示,有機形式的硒比無機形式具有更高的生物利用度[19]。來自有機源的硒比無機形式更容易被吸收,並可以迅速地用於在壓力條件下合成硒蛋白[20,21]。此外,有機形式的毒性水平也低於無機硒酸鹽或硒酸鹽物種,這表明更高的生物利用度可能被更低的毒性水平所抵銷[22]。此外,已經證明,為了在氧化應激條件下調節GPX的抗氧化活性,來自硒蛋氨酸的硒半胱氨酸,在有機硒中通過B6依賴性的轉硫化反應轉化為硒酸鹽並重新合成為硒-半胱氨酸基團,這調節基因表達並激活GPX系統。相比之下,無機硒的代謝途徑是不同的,即它繞過B6依賴性轉硫化過程來調節GPX系統[23,24,25]。最近,有關飲食硒形式的合成和代謝的這些方面已被全面回顧[18,21],不同硒物種的生物利用度也在其他地方詳細回顧[26]。不同形式的硒的代謝命運的簡短描述如圖1所示。為方便參考,硒的不同形式及其特性簡要地在表1中總結。與此同時,為人類和不同動物物種推薦的膳食硒攝入量(RDAs)在表2中列出。
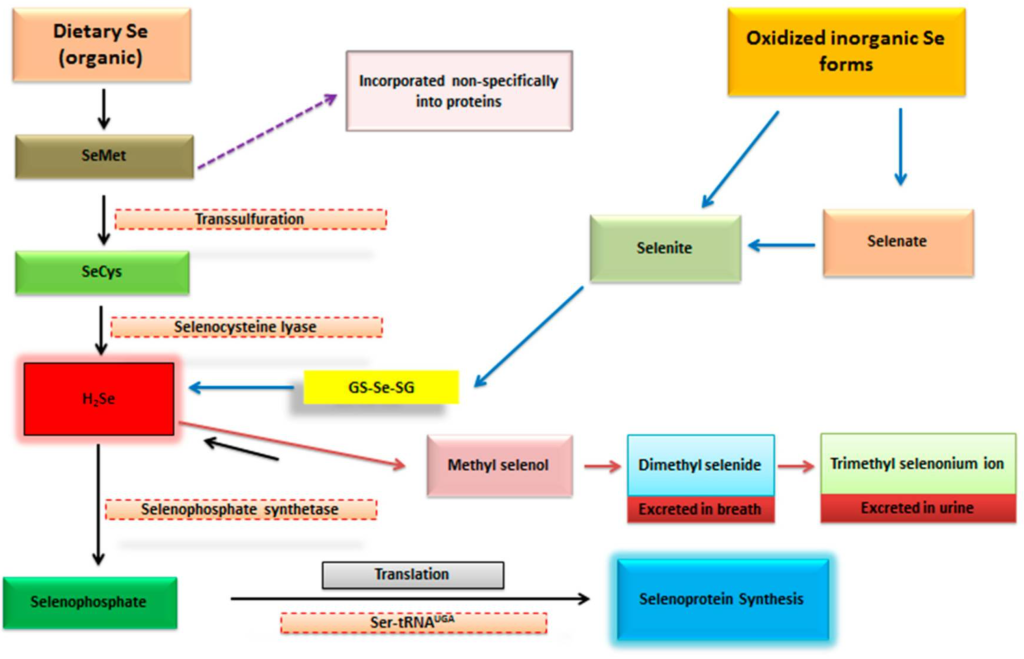
圖1
不同形式的硒的代謝途徑。來自有機來源(硒酵母)和其他食物蛋白質的硒蛋氨酸(SeMet)經歷轉硫化反應並被轉化為硒半胱氨酸(SeCys)。然後硒半胱氨酸被轉化為氫硒化物(H2Se);此反應由特異性酵素硒半胱氨酸裂解酶催化。氫硒化物通過硒磷酸合成酶轉化為硒磷酸,並隨著與tRNA結合的絲氨酸殘基的反應,它產生一個SeCys結合的tRNA,從中SeCys共轉譯插入並進一步翻譯為硒蛋白(GPX, SELENOP等)。氫硒化物也可以被甲基化和解毒,並通過呼吸(作為二甲基硒化物)和尿液(作為三甲基硒鹽離子)排泄。或者,硒蛋氨酸也可以非特異性地被合成到蛋白質中,如白蛋白和血紅蛋白,取代甲硫氨酸。無機形式的硒,如硒酸鹽和硒酸鹽,通過硫醇依賴的還原反應進行代謝,產生氫硒化物,這是硒蛋白的合成的起點,如前面所描述的有機形式[22,23]。定義:GS-Se-SG: 硒二谷胱甘肽;GPX: 谷胱甘肽過氧化物酶;H2Se: 氫硒化物;Se: 硒;SeMet: 硒蛋氨酸;SeCys: 硒半胱氨酸;SELENOP: 硒蛋白P;Ser-tRNAUGA: 絲氨酸tRNA(也是Sec-tRNA[Ser]Sec),以及在硒蛋白信使RNA中存在的特異的內部停止密碼子(UGA)。
表格1 硒形式的簡要描述。
| 物種 | 一般描述 [27] | 相關文獻 |
|---|---|---|
| 硒蛋氨酸 (Selenomethionine) | 它是氨基酸甲硫氨酸的硒類似物;此形式通常來自植物來源(特別是穀物)、硒酵母和其他硒補品。動物食品中也有報導。它在甲硫氨酸的位置非特異性地插入到體內蛋白質中。因此,含有硒蛋氨酸的補品被認為具有更多的生物利用度的硒。 | [18,26,27,28,29,30,31,32,33,34,35,36] |
| 硒半胱氨酸 (Selenocysteine) | 這種形式存在於動物食品中(來自它們的硒蛋白質)並且是氨基酸半胱氨酸的硒類似物。 | [18,26,27,30,32,33,36] |
| Selenoneine(2-硒基-Nα,Nα,Nα-三甲基-L-組氨酸) | 這是一種在魚類,例如金槍魚和鯖魚中新發現的主要硒物種;但在烏賊、吳郭魚、豬和雞中含量較低。這種形式具有強烈的自由基清除活性。 | [27,37] |
| Se-甲基硒半胱氨酸 和 γ-谷氨酰基-Se-甲基硒半胱氨酸 | 這些也來自植物來源,如硒濃縮酵母、大蒜、洋蔥和西蘭花。通常被認為是解毒產品,特別是在硒蓄積器和Brassica和Allium家族的植物中形成。 它被代謝成甲基硒醇,據信具有抗腫瘤效果。 這些的生物利用度數據不存在 [18]。 | [18,26,27,35,38,39] |
| 鈉硒酸鹽 和 硒酸鹽 | 膳食補充劑的組件;有時硒酸鹽出現在水供應中。部分硒酸鹽存在於植物來源(如捲心菜)和魚中。 | [18,26,27,32,33,35,36,40,41,42] |
表格2 人類和各種動物物種的硒建議膳食攝取量 (RDAs)(數值根據Qazi等人2018 [43]調整)。
| 物種 | 建議膳食攝取量 (RDA) |
|---|---|
| 成年男子 | 男:55 µg/天 *; 女:55 µg/天 * |
| 羊和山羊 | 100–200 µg/kg 乾物飼料/天 |
| 豬 | 150–300 µg/kg 乾物飼料/天 |
| 馬 | 100 µg/kg 乾物飼料/天 |
| 驢 | 150 µg/100 kg 體重 |
| 乳牛 | 100 µg/kg 乾物飼料/天 |
| 肉牛 | 300 µg/kg 乾物飼料/天 |
| 小牛 | 100 µg/kg 乾物飼料/天 |
| 駱駝 | 400–800 µg/天 |
作為一種重要的微量元素,硒在動物和人類健康的細胞和生物層面上具有許多基本的角色,並與各種病理生理狀況相關[27,43,44]。已經證明硒的缺乏和過量都會影響氧化還原狀態,並在動物和人類中導致不良的健康結果[45]。硒的生物功能主要由硒蛋白來執行,這在生命的所有三個領域中都有證明[43,46]。作為硒蛋白的一個必需組成部分,硒執行結構和酶的角色;在後者的情境中,它以其催化和抗氧化功能而聞名[43,44]。所有的硒蛋白至少包含一個含硒的半胱氨酸(Sec),這是一個含硒的氨基酸(第21種“自然發生”的氨基酸)[43,47,48],它在對UGA密碼子的回應下與始生的多肽鏈共同翻譯。 UGA密碼子通常用於結束翻譯過程[46]。值得一提的是,硒蛋白的信使核糖核酸(mRNAs)具有兩個與其他mRNAs不同的特徵。其中一個獨特的特點是在開放讀取框架(ORF)中存在UGA,另一個是在mRNA的3′非翻譯區域(3′ UTRs)中的硒半胱氨酸插入序列(SECIS)元素(幹-環結構)[19]。該SECIS元素參與控制UGA密碼子作為硒半胱氨酸的正確重碼,從而阻止截斷蛋白的合成[49]。然而,硒蛋白的合成仍然是一個複雜的過程,因為其調節是由許多可變部分介導的,所以它仍然不完全被理解[19,46]。有趣的是,有建議說多種SECIS結合蛋白也可能在控制硒蛋白表達的層次結構中有組合模式的含義。因此,需要更多的研究來闡明不同SECIS結合蛋白在控制硒蛋白表達層次結構中的生理功能[46]。核硒蛋白mRNPs(信使核糖核蛋白)的組裝和運輸所涉及的步驟在圖2中顯示。
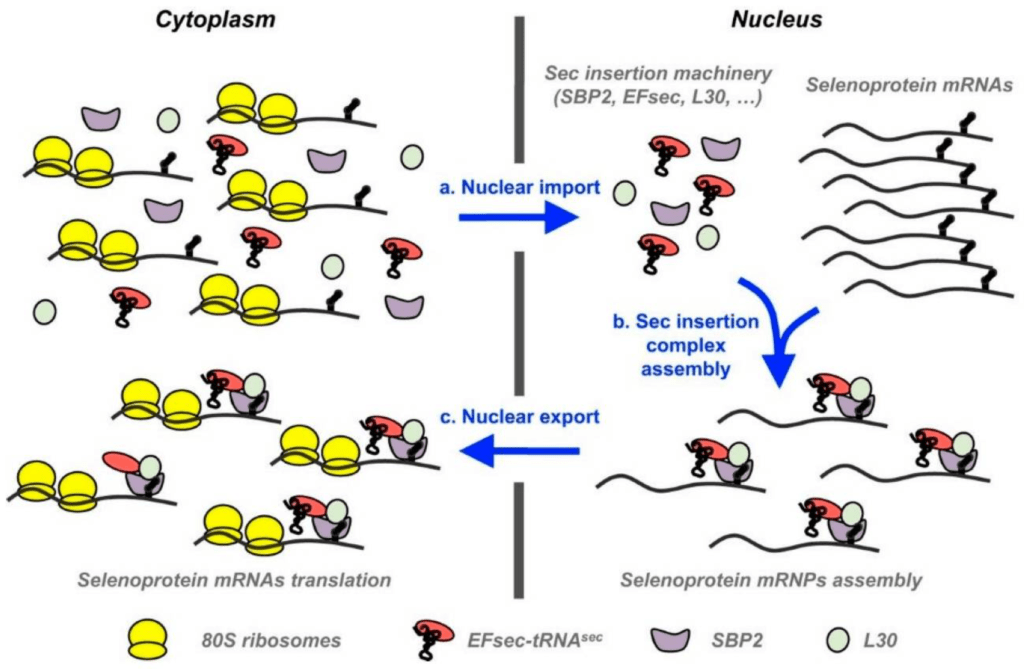
最近,已證明哺乳動物和體外培養細胞中硒蛋白的表達受硒水平調節[19,49]。這種調節主要發生在翻譯階段,並在mRNA轉錄水平上有中度調節。這種選擇性的表達調節確保了必需的硒蛋白在其他蛋白的損失下被維持[19,49]。有趣的是,在硒供應不足或低的情況下,一些硒蛋白如麩質過氧化物酶4(GPX4)的合成優先於其他蛋白[50]。相反,麩質過氧化物酶1(GPX1)被認為是對硒狀態變化最敏感的硒蛋白之一,在低硒狀況下,其mRNA和蛋白質的水平大幅降低[51]。在這些條件下,Gpx1被下調(釋放硒),以便硒蛋白P(Selenop)可以維持,將硒運輸到其他組織和細胞[19]。在硒缺乏的條件下,硒蛋白的表達降低很可能是由於mRNA轉換速率的變化導致的,而不是轉錄調節。還認為,Sec的合成是硒蛋白合成的一個限制步驟,這與由飲食硒調節的硒蛋白表達的主要原因是無意義介導的衰變[46]。此外,還應該指出,目前,硒狀態和其他混淆因素之間的相互作用也研究不足,特別是;對硒蛋白在氧化應激或硒豐富條件下的調節研究明顯不足[52]。最近,已證明在硒有限的條件下,某些抗氧化硒蛋白的表達也受到氧化應激的調節[49]。有趣的是,報告說,在硒蛋白表達下調的情況下,反應性氧物種(ROS)、內質網(ER)應激和氧化介導的DNA損傷的水平增加是預期的事件,這導致細胞內環境的損害和細胞週期進程的干擾。在補充硒的條件下,某些硒蛋白的表達增加,並可能在有效抵抗氧化應激相關挑戰中的有害ROS水平中起到關鍵作用[49]。
在其他方面,SELENOP值得特別提及,因為它包含多於一個Sec[19],作為一個主要的血漿硒蛋白,它主要從肝臟運送硒到其他幾個器官[53,54],並參與器官內的硒運輸和代謝[19,47]。像大多數已知功能的硒蛋白一樣,SELENOP也具有N端含Sec的硫氧還蛋白功能域,這表明其可能的氧化還原功能。許多其他硒蛋白,如硒蛋白H(SELENOH)、硒蛋白T(SELENOT)、硒蛋白V(SELENOV)和硒蛋白W(SELENOH),也具有像硫氧還蛋白這樣的域,指定氧化還原相關的角色[19,55]。然而,許多硒蛋白的個別特性和生物學角色仍然主要未知[27,43,56]。最近,已在描述硒蛋白和解釋其生理作用方面取得了重要進展[46]。但是,進一步的硒蛋白功能表徵和硒蛋白組分析可能會闡明硒的不同生物學角色,並幫助識別依賴於硒蛋白的新的分子途徑和生物學過程[46]。
理由
在過去的十年中,許多研究和少數文獻回顧都報告了硒(Se)和硒蛋白質在哺乳動物生殖中的強烈含義[14,43]。然而,仍然有很大的需要將新的研究成果和批判性思考結合起來,並將信息壓縮以更好地理解Se在男性生殖中的功能。因此,在這次回顧中,我們詳細評估了到目前為止(2019年)發布的相關研究(動物和人類),描述了硒和硒蛋白質在男性生殖功能、相關疾病狀況和實驗性誘導的挑戰中的含義。
男性生殖相關的重要硒蛋白
葡萄糖醛酸酶家族(GPX)有八種不同的酶同型體(GPX 1-8)在多種氧化還原反應中發揮重要作用。值得注意的是,GPX1到4和GPX6是硒蛋白,而其他同型體則含有Cys。此外,只有GPX6在人體中是硒蛋白[57]。這些酶同型體的主要作用是通過催化(通過葡萄糖醛酸酶)過氧化氫(H2O2)、有機過氧化物和脂質過氧化物的還原來保護細胞免受氧化應激的傷害。所有這些都是組織特異性的,且明顯具有性二型表達[58]。
葡萄糖醛酸酶4,也被稱為PHGPx(磷脂過氧化物GSH Px),是一個經典案例。它在睪丸中明顯表達,具有抗氧化和結構上的作用;後者可從它在成熟精子的中片粒線體膜(作為氧化失活的蛋白質)中占超過50%的事實中看出[9]。在精子生成的早期階段,GPX4被認為保護發育中的精子免受氧化應激誘導的DNA損傷。然而,在後期,通過與中片區域的蛋白質交聯,它通過成為繞繞旗鞭的粒線體鞘的結構成分來維持精子中片的完整性,這是精子穩定性和運動能力的必要組成部分[59,60,61,62]。由單一GPX4基因編碼的三種具有不同N端氨基酸序列的同型體,即:粒線體(mGPX4)、細胞質(cGPX4)和核變體(精子核葡萄糖醛酸酶4,snGPX4)分別位於粒線體、細胞質和核中[63]。在完全針對Gpx4的干擾後,同型雜合Gpx4基因敲除(KO)小鼠在早期胚胎發育中呈現致死性;但另一方面,儘管其Gpx4 mRNA和蛋白水平下降,雜合型小鼠仍能生存,繁殖並看起來正常[63]。Conrad等人[64]顯示,具有指向性刪除的snGpx4基因的小鼠不僅能生存,而且完全具有生育能力,與完全KO小鼠形成對比。cGpx4變異體的刪除導致早期發育缺陷(在[65]中進行了評論)。另一方面,Schneider等人[66]顯示,在小鼠模型中,即使在目標性刪除mGpx4後,仍然可以實現正常的胚胎和出生後發育;但是,這種情況導致雄性不育。有趣的是,當使用mGpx4−/−精子進行胞質內精子注射後,繞過所產生的不育,並生產出可生存的後代[66]。Imai及其合作研究者[67]展示了GPX4對人類男性生育能力的重要性。他們發現GPX4在晚期生精細胞和生精細胞中豐富分佈,並位於精子的中段,特別是在粒線體中。這些作者還報告說,在被檢查的受試者中,除了10%的不育男性外,所有人的精子中GPX4水平都顯著下降。然而,從育性男性的精子中沒有觀察到GPX4的異常表達[67]。然而,這些結果被Foresta及其同事[9]確認,他們報告精子的結構完整性和運動性與GPX4的濃度直接相關。同樣地,與對照組相比,不育男性的殘留GPX4活性顯著降低,特別是在精子數量和活性降低的男性中。這種活性與前進運動性、但也與生存能力和結構完整性直接相關[9]。在2009年對鼠類模型的另一項研究中,進一步證明了Gpx4水平降低導致男性不育[68]。這得到了進一步的支持,因為證據表明mGpx4 KO副睪精子無法在體外受精卵[68]。因此,無論GPX4減少的原因是什麼,它都可能被視為確定生育能力的預測工具[9]。體外受精(IVF)研究也已擴展,以評估精子GPX表達對受精能力、胚胎質量和整體生殖結果的一般影響。從GPX4 mRNA表達較低的精子樣本中獲得了更多的不對稱胚胎(在第3天)。然而,GPX4水平對體外發育的後期(在第5和6天)或懷孕率沒有影響[69]。
除此之外,最近Parillo及其同事[70]報告指出,在健康的Chianina公牛的生精小管(頂部區域)中觀察到GPX4蛋白的強烈表達信號,它位於成熟精子的細胞質區域,即,生精細胞、圓形生精細胞和延長的生精細胞。同樣,也在副睪和射精精子,特別是在頭蓋區域,觀察到免疫信號。這些在精子成熟的不同階段的強烈信號與早期的生化觀察結果一致,表明GPX4對於牛和其他哺乳動物的精子的最佳發育和功能是必不可少的[70]。
與GPX4一樣,人們也認為SELENOP在男性生殖功能中起著至關重要的作用。它作為Se的運輸蛋白質,也在sertoli細胞基部的囊泡樣結構中表達[71]。此外,Selenop mRNA也在大鼠的Leydig細胞中表達(稍後在3.1中討論)。報告指出,男性Selenop KO小鼠的生育能力明顯降低,Se水平降低,而Gpx活性降低[72]。與此同時,富含Se的飲食不能恢復這些小鼠的睪丸Se水平或正常的精子表型[71]。在mGpx4 KO小鼠模型中,X射線螢光顯微鏡觀察揭示了Se水平下降60%,從而導致了精子生成的嚴重受損。但是,在Selenop KO模型中表現出的Se的最大損失是77%[73]。除了這兩種特殊和典型的硒蛋白質(GPX4、SELENOP),其他如GPX1和GPX3也在男性生殖組織和分泌物中表達,並與男性生育能力有關。GPX1和GPX3被很好地代表和描述,位於副睪上皮和精子中。這些硒蛋白質被報導可以保護副睪實質和成熟精子免受氧化應激的傷害(見文獻[74]中的評論)。
上述證據強調,Se在男性生殖系統中執行重要的功能,這些功能由硒蛋白質調節,特別是GPX4和SELENOP。因此,建議進行更多的研究,重點闡明這些(GPX4和SELENOP)硒蛋白質在男性生殖功能中的其他角色。無論如何,尋找其他生物學上相關的硒蛋白質可能調節的潛在機制也應該包括在未來研究的範疇內。在任何情況下,表3中總結了選定的哺乳動物硒蛋白質(在小鼠模型中表達),它們在男性生殖功能中具有潛在的意義。
表格3
與男性生殖相關的已知哺乳動物硒蛋白質的簡要描述。
| 硒蛋白質基因 * | 符號 [12] | 一般描述/功能 | mRNA * | 蛋白質 * | 與男性生殖功能的相關性 |
|---|---|---|---|---|---|
| 谷胱甘肽過氧化酶4 | Gpx4 | 脂質過氧物的解毒,膜中的抗氧化劑,作為精子中的結構蛋白,還與凋亡有關 | ++++ | ++++ | 精子中片線粒體鞘的結構蛋白並涉及精子染色質濃縮[75]。涉及男性生育能力[68]。 |
| 硫氧還蛋白-谷胱甘肽還原酶 | Txnrd3 (TGR) | 是硫氧還蛋白系統的一部分,抗氧化功能,氧化還原調節,細胞信號 | + | + | 涉及二硫鍵的形成和精子成熟過程[76]。在青春後睪丸中表達,尤其在線粒體鞘形成的地方,長條形的生殖細胞中含量豐富[75]。 |
| 硒蛋白P | Selenop | 主要負責硒的運輸並執行抗氧化角色。被認為是血漿硒的主要貢獻者和硒狀態的可靠生物標誌物。其缺乏導致鼠類精子異常的不育 | + | + | 涉及男性生育能力[77,78]。涉及向生殖生殖細胞輸送硒[71]。對鼠類精子的發育至關重要[79]。 |
| 硒蛋白V | Selenov | 大部分未知,可能在氧化還原調節中起作用 | + | n.d. | 專門在齧齒動物的睪丸中表達[80]。原位雜交試驗已經顯示了鼠類生殖小管中Selenov mRNA的表達,但其在精子生成中的確切功能尚未大規模探索[48,80]。 |
| 硒蛋白W | Seleno w | 抗氧化保護 | + | + | n.d. * |
| 硒蛋白K | Selenok | 可能在心肌細胞中提供抗氧化保護,內質網跨膜蛋白 | ++ | n.d. | n.d. * |
| 硒蛋白F | Selenof | 在細胞凋亡中的作用和介導硒的化學預防效應 | + | n.d. | n.d. * |
| 硒蛋白S | Selenos | 細胞氧化還原平衡,可能影響炎症反應 | + | n.d. | n.d. * |
| 硒酸鹽合酶2 | Sephs2 | 需要合成硒酸鹽,硒半胱氨酸的前體, |
硒在男性生殖中的作用
過去,Behne 和他的同事執行了一系列的研究,觀察硒在雄性大鼠中的調節及其重要性;這些作者報告稱,在硒攝入不足的情況下,其供應到睪丸的優先級高於其他組織和器官。隨後,這些研究的結果讓人認為硒可能參與著睪丸激素的生物合成[11,81]。
硒在類固醇生成和精子生成中的作用
主要性激素(睪酮)的最佳濃度對於精子細胞的正常發育是必要的。在睪酮生物合成的過程中,會產生ROS,而它們的過量產生會導致男性不育[82]。有趣的是,大約二十年前,研究者在大鼠的萊杰細胞中選擇性地識別到Selenop mRNA [82,83]。有建議說,除了作為運輸硒的血漿硒蛋白質的作用外,Selenop 可能還在萊杰細胞中起到一種細胞內抗氧化劑的作用[83]。此外,細胞質中的 Gpx 也被認為是對抗由於睪酮生物合成產生的H2O2,但其在睪丸中的表達相對較低[82]。然而,對於Selenop在萊杰細胞中對類固醇生物合成的影響,除了其細胞內的抗氧化劑角色,提議Selenop還可能作為一種細胞外抗氧化劑,保護萊杰細胞免受氧化損傷。隨後,在2001年,利用老鼠和大鼠模型,報導了Selenop在萊杰細胞中的睪酮產生的生理功能[82]。認為Selenop在保護萊杰細胞免受來自睪酮生物合成途徑的氧化損傷中起到了重要的抗氧化作用[82,83]。
在任何情況下,越來越多的文獻也建議硒在睪丸素的生物合成中也很重要。有研究建議,血液中的睪丸素濃度與硒的濃度有正相關[84,85]。同樣地,已證明膳食硒補充劑能夠改善不同動物種類中的睪丸素水平和精液質量[12,86,87,88]。但是,調節睪丸素生成的確切基礎機制尚不清楚,需要進一步的了解。由於睪丸素是由萊鐸細胞產生的,它們可以作為一個潛在的目標模型,進一步研究硒相關調節睪丸素合成的機制[89]。已經證明,硒在某些基本的細胞功能中有潛在的調節作用。據報導,這一作用是通過激活細胞外信號調節激酶(ERK)信號傳導途徑來調節的[90]。但是,透過ERK信號傳導途徑以及萊鐸細胞在精子發育過程中的命運調節硒在睪丸素生物合成中的確切作用尚不完全理解[89]。在這方面,Shi等人在一個體外研究中揭示了硒可以調節綿羊萊鐸細胞中的增殖和與凋亡相關的細胞事件。這些效應主要是通過調節氧化應激、細胞週期和與凋亡相關的生物標記物來實現的。與對照組(無硒)和高硒處理組(4.0和8.0μmol/L)相比,2.0μmol/L組中的ROS含量最低,GPX活性最高。他們進一步報告說,硒還可以通過激活ERK信號傳導途徑和其下游基因的表達,例如急性調節類固醇(StAR)和3β-羥固醇酸酯酶(3β-HSD),來增加萊鐸細胞中的睪丸素生物合成。這些生物標記物被認為與硒在男性生育和生成中的調節含義密切相關。硒的最佳水平(2.0μmol/L)引發了這些基因表達的顯著上調,並改善了睪丸素的生物合成。但是,當培養基中的硒濃度增加到(8.0μmol/L)時,萊鐸細胞的增殖能力和細胞週期相關生物標記物的表達都減少了,進行凋亡的細胞比例也顯著增加。引人注目的是,後者的發現與促凋亡相關標記的相對表達一致[89]。有趣的是,母體膳食硒補充劑(0.5, 2.0 mg Se/kg乾物(DM))導致與睪丸組織形態學相關的統計學上較高的指數,並在“Taihang Black”公山羊的睪丸間質中記錄到明顯較高(與對照組相比)的生成細胞系和萊鐸細胞密度[91]。相比之下,這些指數(睪丸重量和體積)在硒過量(4.0 mg/kg)組中顯著減少。在Se處理組中觀察到睪丸組織和血清中的睪丸素水平增加,以及睪丸素生物合成相關生物標記的表達增加。當母體
飲食中的硒水平增加時,StAR, 3β-HSD和cytochrome P450 family 11 subfamily A member 1 (CYP11A1)的相對mRNA表達減少。母體飲食中的硒補充劑也可能影響後代睪丸中雄激素受體蛋白的表達[91]。此外,在一項有趣的新生牛犢睪丸的比較轉錄組學研究中,Cerny和同事[92]報告稱,在妊娠期間餵飼母牛的硒形式(35 ppm有機硒, 35 ppm無機硒, 和50:50兩者的混合物(MIX))對於調節固醇生成和/或生成相關的編碼蛋白質的幾個mRNAs的表達產生了不同的影響。與在妊娠期間餵飼無機硒的母牛所生小牛相比,觀察到固醇生成和生成相關的mRNAs的較為顯著和理想的轉錄表達[92]。值得注意的是,餵飼MIX(50:50有機和無機硒)的母牛所生的新生小牛睪丸顯示出一種獨立的轉錄組學表型,這不是有機和無機組之間的中間型[92]。值得一提的是,此分析中使用的所有小牛都具有高/充足的硒狀態,並且出生於具有高/充足硒狀態的母牛。然而,目前,這些不同的轉錄組學事件的機械和生理基礎尚不完全理解,期待未來使用足夠數量的動物進行的大型研究。然而,之前已經證明,有機硒比無機補充牛的血液和肝組織中的硒水平更高[92,93,94]。
與其在固醇生成中的角色類似,硒也被認為在精子生成中起到了重要作用。在對硒在男性生育和繁殖中的作用的經典研究之一中,Watanabe和Endo [95] 檢查了攝取硒缺乏飲食的老鼠的精子和精細胞染色體的形態。他們報告說,與對照組 (4.0% 到 15.0%) 相比,硒缺乏組的異常精子比例很高(6.8% 到 49.6%)。在精子頭部,形態缺陷比在其他區域,即中段和尾部,更為明顯。然而,精細胞(MI階段)的染色體異常頻率在硒不足組和對照組之間是可比的 [95]。此外,在另一項研究中,缺硒(基於酵母的硒0.02 ppm)的飼料顯著減少了老鼠中精子生成細胞系的數量,即厚絲精細胞,精子和成熟精子 [96]。綜合考慮,這些發現確認硒可能在男性精子生成過程中有強烈的含義。
近期,在對新生小牛睪丸的Sertoli細胞的體外細胞培養研究中,顯示在培養基中加入硒補充劑(無機硒;0.25、0.50、0.75和1.00 mg/L)可能影響細胞的存活能力和表達血-睪丸屏障的重要蛋白質成分(occludin、connexin-43、zonula occluden、E-cadherin)的情況。事實上,硒的這種效應是劑量依賴性的,並呈U形反應,即在適中劑量(0.25、0.50)觀察到最佳的修復效果,而當劑量增加到0.75和1.00 mg/L時,暫時的細胞毒性效應變得明顯 [97]。有趣的是,這些硒的效應的機械基礎後來被同一研究小組進一步闡明 [98],他們證明了硒預處理可以改善微囊素-LR(MC-LR)引起的小牛Sertoli細胞的細胞性毒性。用無機硒(0.50 mg/L)預處理抑制了培養的Sertoli細胞中的核因子kappa B(NFκB)的活化。硒還表現出一些免疫調節作用,這可以從抑制MC-LR暴露的Sertoli細胞中的炎症性細胞因子活化中觀察到 [98]。此外,硒預處理還調節了與粒線體相關基因的表達,如Cytochrome c oxidase subunit I(COX-1),Cytochrome c oxidase subunit 2(COX-2),Acetyl-CoA acetyltransferase 1(ACAT1),Mitochondrial transcription factor A(mtTFA)和NADH dehydrogenase的Subunit 2(MT-ND2)。硒處理還調節了Sertoli細胞中的凋亡事件,這主要是通過抑制cytochrome-c的釋放和caspase-3的表達來誘導凋亡。與MC-LR暴露組相比,硒處理的Sertoli細胞中血-睪丸屏障的成分的誤置也被抑制。引人注目的是,硒的特殊抗氧化效應也被觀察到,這可以從培養的Sertoli細胞中GPX4活性的增加中觀察到 [98]。由於NFκB和粒線體信號通路,以及血-睪丸屏障(保護睪丸實質的重要措施)在睪丸實質中的細微細胞功能中都有涉及,這些研究的結果合理地提供了新穎和引人入勝的證據,表明硒至少在某種程度上可能有助於改善Sertoli細胞相關的精子生成和男性生育的干擾。然而,涉及其他動物模型的體外和體內研究都將是有趣的,並有可能為硒在Sertoli細胞功能和精子生成中的修復作用提供具體的證據。
亦有實體證據(體內)顯示硒可能透過調節與細胞週期和凋亡相關基因的表達而在調控精子生成過程中起作用[99,100,101];但這種硒介導的調節的精確機制仍不清楚[89]。已有證據顯示,紅氧激活轉錄因子、啟動蛋白1(AP-1)的組成部分(cjun和cfos)調節細胞的增殖和分化,並參與調節信號傳導途徑,並在甾體生成和精子生成中起到調節作用。還顯示,轉錄因子(AP-1)、cfos和cjun的表達是階段特異性的,並在精子生成的活躍階段增加[102]。報導說,當小鼠餵食硒缺乏飲食(酵母基飲食含0.02 ppm硒)時,與接受適量硒(0.2 ppm無機硒)飲食的小鼠相比,其睪丸的硒水平顯著下降,而與硒適量和硒缺乏組相比,硒過量組(1 ppm有機硒)中觀察到的增加則明顯。硒缺乏組的GPX活性和脂質過氧化(LPO)水平分別下降和增加。有趣的是,硒缺乏小鼠中cfos和cjun的mRNA和蛋白質表達也觀察到顯著增加[102]。值得注意的是,8週的硒缺乏導致精子生成細胞數量顯著減少,即厚絲精細胞,晚期和成熟精子。引人入勝的是,對早期階段生殖細胞動力學的硒缺乏效應較不明顯,這暗示硒缺乏可能影響在其他類似研究中觀察到的整體精子質量參數[102]。已建議,在減數分裂階段失去AP-1(cJun/cFos)表達可能涉及防止這些寶石細胞分化成精子[103]。還證明,硒缺乏,及到較小程度,硒過量干擾這些調節過程。對於高硒水平對AP-1的調節影響,建議在較高水平的硒與蛋白質中存在的GSH和硫醇反應,有助於構成-S-S-和GS-Se-SG。由於Fos和Jun的調節是由關鍵半胱氨酸殘基的氧化狀態介導的,因此過量硒的氧化可能會阻止cJun同源二聚體在啟動子位點的結合,並可能導致cjun mRNA減少[103]。此外,已經證明,酸性蛋白酶(MAPK)參與調節cfos基因的表達,且高硒水平已與抑制MAPK/c-Jun氨基端激酶(JNK)途徑相關聯。因此,這兩種機制被建議參與在硒過量狀況下降低cjun和cfos的表達[96]。相反,這些轉錄因子在限制硒條件下的表達減少可能歸因於增加的ROS水平及其在這些轉錄因子的啟動子位點的後續氧化損傷,因為在硒缺乏條件下對AP-1控制序列的結合減少[103]。
同樣地,NFκB,一個廣為人知的紅氧調節轉錄因子,據報導在精子生成中起著重要作用。已經顯示,雄性小鼠消耗硒缺乏飲食(0.02 ppm無機硒)時,兩個p65和p50基因(NFκB的組成部分)的相對表達增加[101]。此外,硒缺乏小鼠中的誘導型一氧化氮水平和抑制蛋白IκB的表達分別增加和減少[101]。此前,還建議在睪丸的氧化應
激條件下,NFκB蛋白在精子生成細胞中起促凋亡作用,這提出了一個假設,即NFκB的增加表達可能導致過多的生殖細胞死亡和減少生育能力。因此,這些發現明確地證明,減少的硒供應可能通過調節睪丸中的NFκB的表達和活化對小鼠的生殖效率和精子生成產生潛在的負面影響[101]。引人入勝的是,已經證明硒介導的氧化應激也可能影響HSP70、HSP70-2和MSJ-1(精子生成細胞特異性HSP70-2的伴侶蛋白)的表達,這有助於降低小鼠的精子生成和生育能力[104]。此前還證明,硒水平(缺乏或過量)的改變可能導致小鼠精子生成細胞中的凋亡(p53介導)顯著增加[100]。因此,這些發現和之前描述的發現為了解硒介導分子機制對精子生成和男性生育產生的不良影響提供了合理的見解,並為其理解增加了新的維度。然而,硒水平改變的這些不良效應的確切機制仍然不完全被了解,且需要進一步闡明。
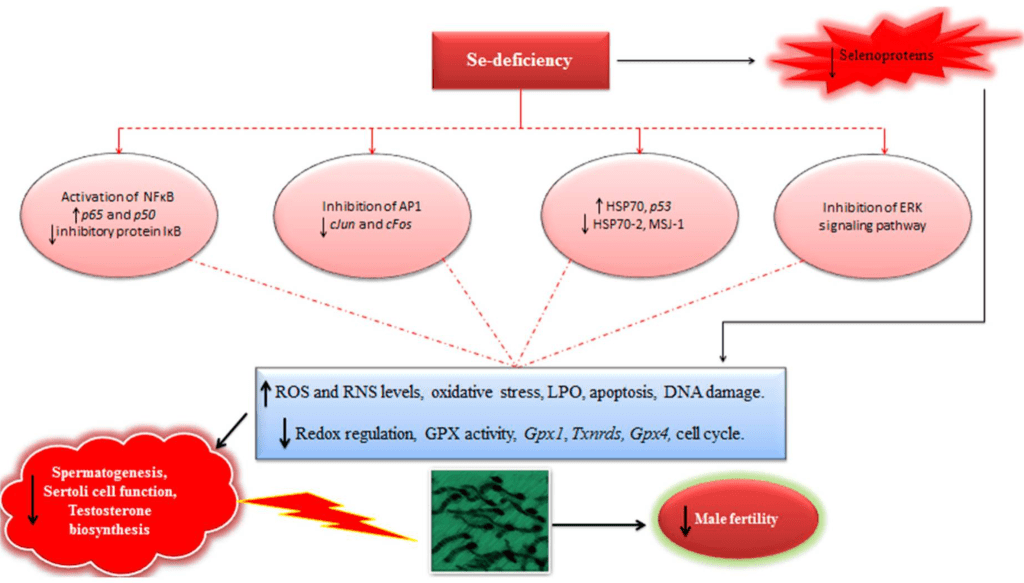
根據現有的證據,我們可以推斷,硒缺乏強烈涉及調節紅氧信號傳導和細胞內氧化壓力,觸發了多個紅氧敏感的轉錄和增殖因子的表達,最終影響了精子生成過程和男性生育能力(圖3)。因此,未來應繼續進行專注於解釋硒介導的轉錄和增殖因子調節的高效力研究。此外,也可以預見,像GPX4和SELENOP這樣的硒蛋白可能也在男性的甾體生成和精子生成中具有某些互補作用。例如,原位雜交實驗已在小鼠的生精小管中證明了Selenov mRNA的高水平,但其在精子生成中的確切功能仍然大部分未被探索。最近已經證明,雞的蘇熟精原細胞中的硒蛋白U(在小鼠和人中缺失)可能在調節磷脂酰肌醇3-激酶–AKT–機械性(或哺乳動物)的rapamycin目標(PI3K–AKT–mTOR)信號途徑中有潛在的作用,並可能在SC介導的精子生成中起到新的調節作用[105]。因此,專注於其他硒蛋白,如硒蛋白K(SELNOK)、硒蛋白F(SELENOF)、硒蛋白S(SELENOS)、SELENOW等在哺乳動物同源中可能的生理和調節功能的類似研究也可能提供吸引人的結果,並增強我們對於硒和硒蛋白介導的哺乳動物雄性生殖功能調節的了解。此外,還報導稱季節變化也可能影響精子的產生。因此,強烈建議在適當的高效力研究中(涉及較高的家畜)複製這些發現,以增加對目前所得證據的解釋和比較的信心。同時,這些研究也應該專注於足夠多的精子生成週期,以確保硒補充對甾體生成和精子生成的最佳效果。
硒對男性生育相關參數的影響
已報導精子成熟過程與男性的精子和射精質量,以及整體生殖效能有強烈的關聯。因此,這些過程中的任何異常都可能導致質量不足和較差的射精,以及男性的生育能力下降 [14]。同樣地,增加的硒膳食攝取已被認為能增強抗氧化GPX活性,從而提高男性的生育能力 [15]。同時,如前所述,過多的補充也可能不產生治療效果,甚至對男性的整體生殖結果產生有害效果。
值得一提的是,儘管ROS的過量產生會導致氧化壓力引起的DNA損傷和/或凋亡,膜過氧化和精子運動性減少,但適量的水平是執行一些重要精子功能所必需的,例如活化和酶體反應 [7]。因此,細胞的最佳功能需要在氧化還原調節中有一個微妙的平衡。已經顯示硒水平的變化可能會破壞氧化還原狀態,並可能導致氧化壓力,進而通過改變生物學上重要的標記物的表達和抗氧化酶的活性,不利地影響男性生育能力。為此,Kaushal 和 Bansal [104] 報導,硒水平的變化破壞了HSP70蛋白(熱休克蛋白)的表達特徵,並引發了氧化壓力。當老鼠食用硒缺乏(0.02 ppm 無機硒)和硒過量(1.0 ppm 無機硒)食物時,觀察到與LPO、丙二醛(MDA)和自由基(活性氧物種)相關的氧化壓力標記物的水平顯著增加。此外,硒缺乏的老鼠中GPX的水平減少。相反,硒過量組顯示出較高的GPX水平。有趣的是,兩組的整體生育相關標記都顯著減少 [104]。在另一項類似的研究中,觀察到食用硒缺乏食物的雄性老鼠中LPO增加、氧化壓力增加和GPX水平減少 [101]。最近,已經證明,長達兩個月的有機硒膳食補充劑(0.3 mg/kg 體重)顯著改善了幼雄山羊睪丸的整體形態學和組織形態學指數。與對照組相比,幼雄山羊的GPX和超氧化物歧化酶(SOD)在血清和睪丸組織中的酶活性也顯著改善 [106]。
此外,Stefanov 和同事 [107] 研究了有機(每天每動物1.83g L-SeMet [Sel-Plex])和無機(每天每動物4.0 mg 硒酸鈉)硒補充劑對保加利亞Merino公羊精液參數的影響。經過45天的硒膳食補充後,觀察到被治療的公羊的射精量、精子運動性和整體精子存活率均有所改善 [107]。此外,在最近的一項小鼠模型研究中,Asri-Rezaei 和同事 [108] 觀察到,連續七天內腹注射硒酸鈉(0.50 mg/kg 體重)和Se納米粒子(0.50 mg/kg 體重)可以充分提高睪丸中的硒濃度(在注射後的第28天觀察到)。同樣,抗氧化生物標記的酶活性在硒治療後也顯著改善。此外,與對照組相比,精子質量參數,如總數和
運動性,也得到改善 [108]。總的來說,這些結果證實硒補充劑可以產生有益效果並抵消氧化壓力。
此外,最近在一項有趣的成本效益分析中 [109],已經顯示,飼養有機硒飼料(0.5 mg/kg)的公豬每週產生的精液劑量比飼養無機硒飼料(0.5 mg/kg)的公豬多出約23%。在這項研究中還觀察到收入(26%)的顯著增加 [109]。無論如何,附錄表4中提供了其他動物研究,報告了硒補充劑對不同動物模型中男性生殖效能的影響。同時,圖4揭示了硒補充劑對改善男性生育和生殖的影響。
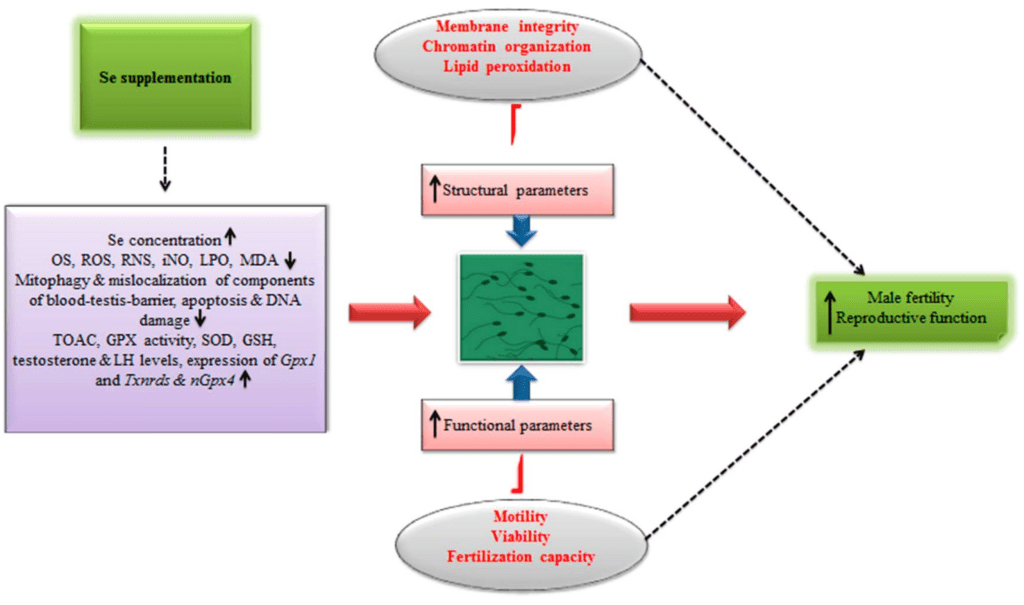
表4 動物研究報告了補充硒對雄性生殖效率的影響。
| 模型 | 處理方式 | 主要觀察報告 | 參考文獻 |
|---|---|---|---|
| Sprague-Dawley大鼠 | 超營養水平的硒奈米粒子 (0.2, 0.4, 或 0.8 mg Se 每公斤體重) | 超營養水平下,所有精子參數如精子濃度、運動力和形態特征都得到改善。但是,當大鼠補充更高水平(非致死水平)的硒奈米粒子,即2.0, 4.0, 或 8.0 mg Se 每公斤體重時,這些參數顯著受到影響。 | [110] |
| Sprague-Dawley大鼠 | 用無機硒處理[0.01(缺乏); 0.25 (適量); 3 (過量); 或 5 (過量) mg 每公斤] 四週 | 觀察到膳食硒對DNA損傷和精子質量的U形反應。硒缺乏表現出較低的敏感抗氧化硒蛋白(Gpx1和Txnrds)的表達。然而,過量的硒損害了精子質量,這與nGpx4的mRNA表達減少有關。 | [111] |
| 小鼠 | 硒補充劑 (無機硒 (0.3 μg/g Se) 或含硒的有機益生菌 (含0.3 μg/g Se) 供應75天 | 有機硒與益生菌共同補充顯著提高了小鼠的雄性生育能力。改善的生育指數包括如減少的睪丸組織損傷、血清睪酮水平的增加,和硒補充組的精子指數的改善。這些改善的生育相關參數被認為是硒的抗氧化功能的結果。 | [112] |
| 小鼠 | 0.2 ppm 硒酸鈉; 1.0 ppm 硒酸鈉 | 兩組小鼠均顯示出與粒線體和質膜相關的缺陷以及精子中的DNA損傷的增加。然而,這些損傷在接觸硒缺乏飼料的小鼠中更為明顯。 | [113] |
| 小鼠 | 硒缺乏食物(0.02 ppm); 足夠的硒(0.2 ppm); 有機硒 | 硒缺乏食物(0.02 ppm); 足夠的硒(0.2 ppm); 有機硒 | [114] |
| 小鼠 | 硒缺乏(0.02 ppm); 硒過量(0.2 ppm); 基於酵母的硒. 小鼠餵飼了4個月 | 硒缺乏(0.02 ppm); 硒過量(0.2 ppm); 基於酵母的硒. 小鼠餵飼了4個月 | [96] |
| 老年小鼠 | 無機硒 0.2 mg/kg 體重 | 在硒處理組觀察到精子參數的改善和CatSper基因的表達增加。 | [115] |
| 兔 | 使用硒奈米粒子處理(400 μg/kg) 60天 | 與對照組相比,硒處理組的血清睪酮水平有所提高。此外,還觀察到射精量和精子質量參數(如精子形態、活性)的改善。 | [116] |
| 公羊 | 0.5 ppm 有機硒; 0.2 ppm 有機硒 | 與攝取0.2 ppm 有機硒的公羊相比,攝取含有0.5 ppm 有機硒飼料的公羊的精液中觀察到硒濃度顯著提高和射精和精子質量的改善。 | [117] |
| 公豬 | 0.5 ppm 有機硒; 0.2 ppm 有機硒 | 與攝取0.2 ppm 有機硒的公羊相比,攝取含有0.5 ppm 有機硒飼料的公羊的精液中觀察到硒濃度顯著提高和射精和精子質量的改善。 | [118] |
| Aardi 公山羊 | 0.5 ppm 有機硒; 0.2 ppm 有機硒 | 兩組硒處理的公山羊都觀察到精子計數和活動性的改善。然而,0.1 mg/kg組觀察到的效果相對更好。 | [119] |
| 公豬 | 0.5 ppm 有機硒 | 經過11週的飼養試驗,有機硒補充劑增加了公豬原始精液中的穀胱甘肽過氧化酶4 (GPX4) 活性和精液劑量的數量。 | [120] |
| 公豬 | 0.3 ppm 有機硒; 0.3 ppm 無機硒 | 經過12週的硒補充後,有機和無機硒處理的公豬精液中的硒含量和GPX活性都增加了。此外,與未添加硒的對照組相比,精子濃度和精子的進展性運動等精液質量參數都有所改善。硒處理的公豬精液對低滲性震盪和熱試驗的液體儲存精液的抗性增強,生育率也有所改善。所有提到的指標在有機硒組都略高於無機組。 | [121] |
| 水牛公牛 | 每週兩次每次10 mg 有機硒; 和 每週兩次每次10 mg 無機硒 | 三個月的硒補充顯著改善了水牛公牛的精子質量參數(射精量、精子運動、濃度和形態)。此外,硒處理組的睪酮濃度也增加了。 | [122] |
| Saanen公羊 | 每十天補充一次的無機硒0.34 mg/kg體重,持續三個月 | 硒補充劑改善了睪丸生物測定和精子參數。從試驗的第40天到第80天,與對照組相比,硒處理組的GPX活性、血漿睪酮和LH水平顯著增加。這些指標在試驗的第80天達到高峰。 | [123] |
| 公牛 | 用硒(100 ng/mL)補充的體外受精(IVF)培養基 | 在Se補充的IVF培養基中孵化1小時後,觀察到精子的粒線體活性顯著增加。此外,在孵化2小時後,硒補充顯示了增加的HOST-positive(低滲性腫脹試驗)精子和精子的額體完整性。與對照組相比,Se處理組觀察到與卵黄膜(ZP)結合的精子數量增加。 | [124] |
以下是翻譯為繁體中文的內容:
重申精子品質參數,如精子濃度、活力、進行性運動和整體精子形態,被認為是評估生殖效能的重要臨床標誌。因此,這些標誌的失調可能導致男性的次生育和不孕。值得注意的是,氧化應激被認為是導致男性不育的一個重要因素[125]。有趣的是,人們認為精子對氧化損傷更敏感;這主要是由於精子的生化組成,即它含有較高比例的多不飽和脂肪酸和較低濃度的胞質抗氧化酶,與體細胞相比[126]。因此,在增加的ROS誘導氧化應激的條件下,由於LPO級聯的觸發,質膜的完整性受到影響。同樣的,增加的氧化應激也被認為是由於染色質凝縮的失調和精子成熟和受精能力的必要過程中的染色質凝縮過程中誘導精子DNA損傷[114]。在這方面,已經證明硒缺乏可能導致通過誘導氧化應激的染色質凝縮和重組過程受損,從而導致男性精子質量受損和受精能力減少[114]。然而,除了前述的以前研究的觀察外,還應該進一步研究著重於對DNA完整性的潛在標誌物的闡明,這將是非常有價值的,並應該對硒在精子生成過程和整體男性生殖能力的角色提供有益的見解。此外,對精子染色質凝縮和重組的深入評估在生物學上也更具相關性,因為在精子生成的後期,組蛋白被精蛋白替代[114]。對硒缺乏模型進行的進一步足夠的研究也將改善我們在這一領域的理解。正如以前的研究所示,硒缺乏可能會損害男性生殖器官的精子品質參數和抗氧化狀態,因此,可以合理地推斷,硒缺乏可能會干擾在氧化還原調節中具有基本作用的硒蛋白的生物合成,從而導致氧化損傷和男性生殖能力參數減少。因此,除了已知的機制外,更多的焦點應該集中在闡明可能參與損害精子/射精液中的硒蛋白介導的氧化還原平衡的其他機制。
與所使用的硒形式相關的研究結果是可比較和鼓舞人心的,即明顯地,有機和無機形式都有可能在不同的動物模型中改善男性生殖能力參數(也參見表4)。為了得到一個更精確的畫面,進行更多的研究,專注於不同形式的硒的比較修復效果,也是合理的。也應該考慮到硒(特別是有機形式)的效果可能受
到補充持續時間的影響;因此,為了獲得不同動物品種改善生殖能力的理想結果,未來的研究也應該在其範疇內包括這一方面。硒奈米粒子也被報導具有更高的生物利用度和較低的毒性潛力,與其他傳統形式的硒相比。然而,關於硒奈米粒子在改善男性生殖能力方面的影響的證據水平仍然不足,更多的多方面研究期待提供確鑿的證據。
硒在精液中和其對男性生殖能力的含義精液被認為在哺乳動物精子的運動能力、活力和保持受精能力方面起著許多基本的作用[127]。Villaverde等人[85]研究了硒在血清中的濃度與家貓精子品質特性、睪酮水平和睾丸形態之間的關聯。硒濃度對睪酮水平和精子產量沒有影響。然而,血液和精液中的硒濃度與精子品質參數之間存在關聯。研究表明,精液中的硒濃度與睾丸總重和精子形態特性,如總頭部缺陷呈負相關。此外,血清中的硒濃度也與一些與精子運動相關的參數,包括平均路徑速度、直線速度和曲線速度呈負相關[85]。這些觀察結果,在某種程度上,突出了硒(在精液中)可能對男性生殖能力有潛在的含義,並且可以用作改善家貓整體男性生殖生物學的一個重要指標[85]。然而,應該注意,這次調查中只使用了少量的貓(n = 6);因此,應該非常謹慎地評估在研究中將硒濃度(作為一個生物標誌物)包括在內,這些研究著重於評估這種微量元素與貓的精子品質和生育能力之間的潛在關聯。此外,為了獲得合理的證據,應該使用貓模型從功能/機制研究中收集更多的數據。同樣地,Bertelsmann和同事們[128]確定了馬精子、精液和精子中的硒含量,以及與整體精子品質和生殖能力的關聯。報導說,精子中的硒水平與精子品質參數,如膜完整性、精子進行性運動、陽性體頭狀態和每次發情周期的妊娠率相關。此外,硒也與馬的改善精子品質和生育能力相關聯。這些發現因此表明,對於馬的男性生殖,評估一個理想的硒狀態需要分析精子中的硒[128]。
值得一提的是,精液中的硒起源於附屬性腺的腺上皮的分泌,即攝護腺、精囊和附睪,因此,精液中硒含量的變化表明這些性腺的硒供應隨飲食中的硒變化。還有證據表明,硒對精子運動的影響可能是由這些性腺的分泌物所調節的,無論是在精子成熟的過程中還是在射精時[129]。因此,對精液和附屬性腺中的硒的潛在功能進行更多的研究也是合理的。這也將改善我們目前對精液中硒濃度與男性生育能力之間關係的基礎機制和生理基礎的理解。
硒(作為微量營養素補充劑的一部分)對男性生育結果的組合效應(動物研究)
近期,僅有少數研究顯示,硒與其他微量礦物質和微量營養素的組合可以改善不同動物品種的生育相關結果。為此,Domosławska和同事們在最近的一項臨床研究中[130]示範了硒酵母(每公斤6微克)與維生素E(每公斤5毫克)補充劑(治療60天)顯著改善了生殖能力降低的臨床健康犬的精液品質參數和抗氧化狀態。在硒補充組中,觀察到如血液硒濃度、平均精子濃度、平均總精子數、精子活動力、以及活精子和正常精子百分比等參數的顯著改善。此外,精子GPX活性和總抗氧化能力(TAOC)也顯著增加[130]。同一研究小組在2015年也觀察到了類似的發現[131],其中硒酵母(每公斤6微克)與維生素E(每公斤5毫克)的飲食補充劑組合60天結果在生殖能力降低的臨床健康犬中改善了精液品質參數,如總精子數、濃度、形態和活動力評分[131]。同樣,Butt等人[132]證明硒(以3g Selemax補充)與維生素E的組合顯著改善了在炎熱潮濕環境下飼養的霍爾斯坦-菲利斯公牛的射精和精子品質參數,並增加了睪酮濃度[132]。此外,Ghorbani等人[133]評估了飲食中的硒(0.3 mg/kg)、鋅(40 mg/kg)及其組合對於繁殖季節中Sanjabi公羊的生殖表現的影響。他們報告說,經過120天的飲食補充後,精子濃度、總精子數和精子運動能力都有顯著的改善。然而,睪酮濃度保持不變[133]。在另一項隨機雙盲研究中,Kirchhoff及其同事[134]未能明確解釋三個月長的Se/維生素E補充劑(含0.1 mg有機硒的片劑;含100 mg維生素E的膠囊)對於正常精子的Cairn Terriers精液質量特性的影響程度。然而,對於某些精液參數,如活精子百分比、精子頭畸形、缺陷的頂體和近端細胞質滴,觀察到補充劑(精子頭缺陷)和時間與治療之間的顯著交互作用。但值得一提的是,該隨機研究中使用的狗的數量太少(n = 9;每個治療組三隻狗),且受試者都是正常精子,即沒有明顯的精液品質缺陷。無論如何,2016–2019三項最近的研究報告了硒和其他微量營養素的組合治療效果,其結果總結在®表5中。
表5 最近的動物研究報告了補充硒(與其他微量營養素結合)對男性生育結果的影響。
| 動物模型及數量 | 治療方案和持續時間 | 關鍵發現 | 參考文獻 |
|---|---|---|---|
| 男性CD-1小鼠<br>(每個實驗組n = 12) | Fertilix® (CellOxess, Princeton, NJ, USA)補充兩個月<br>(Se 55 μg, 鋅 7.5–11 mg, <br>全譜天然維生素E 104–290 mg,<br>番茄紅素 7.5–15 mg<br>左旋肉鹼混合物 200–800 mg<br>葉酸 400–500 mg<br>維生素C 30–90 mg) | 使用抗氧化劑配方的八週預處理完全保護了Gpx5 KO小鼠精子中由氧化壓力誘導的DNA損傷。在陰囊熱應激的小鼠模型中,只有35% (19/54)的雌鼠懷孕,導致169胎鼠和18%的胎鼠吸收(30/169)。相反,在抗氧化劑預先處理的組別中,74% (42/57)的雌鼠懷孕,導致427胎鼠和9%的胎鼠吸收(38/427)。 | [126] |
| 四隻不育的公狗,血液硒水平較低(86.0–165.0 μg/L) | 有機硒0.6 mg/kg和維生素E (5 mg/kg)口服補充60天。 | 經治療的狗顯示精子參數有所改善。在試驗結束時,觀察到血液硒濃度(401 μg/L)增加。當這些狗被用於交配目的時,母狗成功地懷孕並生下4-6隻小狗。 | [136] |
| 十六隻健康的正常精子狗(經過適應期後有兩名患者被排除) | 補充劑包含硒0.27 mg/kg、維生素E 250 mg/kg、維生素B9 1.5 mg/kg、鋅 180 mg/kg,和n-3 PUFA 0.5%,持續給予90天。 | 在治療組中,精子品質參數,即總精子數、濃度、精子活力和膜完整性,與對照組相比有顯著改善。 | [135] |
總的來說,這些研究的結果都是令人鼓舞的,並建議硒與其他必需的微量營養素結合可能提高男性的生殖效率。然而,具體的證據水平仍然不足,且有些不一致。因此,具有強大效力的隨機研究將對建立此方面的堅實科學證據具有很高的價值。還應該指出,這些必需微量營養素綜合混合物的改善效果可能是每一種必需微量營養素的增強和掩蓋效果的結果[135]。目前,這種組合效果的基礎機制尚不清楚,且應在未來的研究中加以考慮[43]。然而,這樣的研究也將為確定旨在改善哺乳動物種類中的男性因子次生育和不孕,特別是家畜和伴侶動物的適當和充足的治療方案提供合理的依據。
硒和精子冷凍保存
儘管對於優化冷凍保存技術已取得重大進展,但與冷凍損傷和哺乳動物精子的凍結耐受性相關的混淆因子和基礎機制仍未完全了解。據認為,冷凍保存會導致結構和功能的損失,也可能導致細胞凋亡和降低受精率。近期已證實,冷凍保存導致多種mRNAs、長非編碼RNAs和microRNAs的差異性表達,這些RNAs涉及如PI3K-AKT、p53、cAMP、細胞黏附、MAPK、鈣信號傳導途徑、環境刺激、凋亡和代謝活動等多種關鍵信號傳導途徑[137,138]。這些有害效果與過量的ROS產生和隨後的氧化性損傷有關,導致總體上降低了精子的質量和受精率。報導稱,在精液延伸液中使用抗氧化劑可以減輕這些損傷,並在一定程度上改善IVF結果;但在這方面仍有很多需要研究的地方。
一項近期的研究[139]報告,當在精液延伸液中加入硒(2 mM)時,水牛公牛的精子質量參數,如活力、濃度和膜完整性,在經過冷凍-解凍後顯著改善。令人驚訝的是,作者報導說使用硒處理的精子進行授精後,水牛的受精率明顯較高(60%對比30%)[139]。然而,應該注意的是,這項研究似乎設計相對較弱,支持數據不提供關於授精後受精率的合理證據。因此,未來有必要在受到良好控制和適當增強的研究中驗證這些發現。相比之下,Khalil等人的研究[140]似乎更具有影響力,結果也更合理。這些作者將不同劑量的硒奈米粒子補充到精液延伸液(Tris-蛋黃果糖)中,並報導稱1.0 mg/mL的硒補充劑在冷凍後顯著改善了荷爾斯坦公牛的精子和精液質量參數,包括膜完整性和精子存活率。此外,硒處理組的抗氧化生物標誌物(如TAOC和MDA)也顯著改善。兩個硒處理組(0.5和1.0 mg/mL)的精子中凋亡和壞死的比率也顯著降低,但在1.0 mg/mL的硒組中觀察到最低的比率。相反,較高劑量的硒(1.5 mg/mL)對精子質量參數產生了一些有害效果,並增加了精子中的凋亡比率。有趣的是,當奶牛使用從硒處理(1.0 mg/mL)組的冷凍精子進行授精時,受精率顯著提高(90%對比59%)[140]。儘管這種證據的質量和水平仍然很低,但這些發現在一定程度上支持了這樣的觀點,即硒補充劑,尤其是奈米形式,可以整合到精子冷凍保存協議中,隨後,使用冷凍保存的精子進行授精後,農場動物的受孕率可以得到提高。
硒補充對雄性生殖系統中不同實驗性誘導挑戰的影響 (動物模型研究)
有關飲食中不足的硒濃度可能的基因毒性效應的科學知識相對匱乏。近期,Graupner 和同事 [141] 研究了小鼠二代Se缺乏的基因毒性效應。他們調查了兩代硒缺乏飲食 (0.01 mg/kg) 對小鼠睪丸組織中誘導的前突變DNA損傷和突變的後果。通過在兩代中提供Se缺乏飲食,從親代開始並在受精、妊娠、出生後持續到子代達到早期成年期,模擬了終生硒缺乏。作者報告說,與接受硒適量 (0.23 mg/kg) 飲食的小鼠相比,硒缺乏飲食的小鼠睪丸組織中記錄到更高的內源性DNA損傷 [141]。因此,這些發現在某種程度上表明,世代間的硒剝奪是基因毒性的,可能對雄性生育力和新的突變傳給子代有可能的影響,並證明需要進一步詳細的闡釋。此外,涉及人類和動物模型的各種報告均表明,精索靜脈曲張引起的氧化應激水平增加可能對雄性睪丸組織和精液有潛在的不良影響。最近,Taghizadeh 和同事 [142] 表明,無機Se的飲食補充劑可以改善Wistar雄性大鼠模型中實驗性誘導的精索靜脈曲張睪丸損傷。儘管精索靜脈曲張的病理生理基礎尚不清楚,但這項研究的發現提供了合理的證據,表明大鼠的精索靜脈曲張引起的睪丸損傷可以通過補充硒來改善,而Se的這些改善效應可能與其強大的抗氧化和催化特性有關 [142]。
近年來,已經報導了許多評估硒在改善不同實驗性誘導模型中的生殖效率的潛在意義的研究。值得注意的是,Gan 和同事 [143] 最近表明,硒-奈米粒子可以改善受鎳 (Ni) 曝露影響的大鼠的生殖效率。當硒-奈米粒子 (0.5, 1.0, 和 2.0 mg/kg) 補充 (口灌) 14天時,適量地改善了由Ni誘導的睪丸損傷、DNA變異和睪酮生物合成,通過調節ERK1/2、p38和JNK-MAPK途徑的磷酸化。硒處理的大鼠中,StAR、CYP11A1和17β-HSD的mRNA和蛋白表達水平也顯著增加 [143]。同樣,最近Kaur和同事 [144] 報告說,硒治療 (0.5 ppm 的亞硒酸鈉/kg 飲食) 可以改善Bisphenol A引起的小鼠睪丸中的氧化損傷和凋亡。與Bisphenol A暴露的小鼠相比,硒治療顯著改善了精子質量參數,如運動能力和濃度,並減少了ROS和LPO水平以及睪丸中的凋亡率 [144]。與Bisphenol A暴露組相比,Se處理組中觀察到更多的生殖細胞數量 (如精原細胞、生殖細胞、圓形和伸展的精子) [144]。在另一項以老鼠為模型的研究中[145],硒酵母的補充(呈劑量依賴方式)充分緩解了雌醇酮誘導的睾丸組織和精子的損害。在接受硒治療的老鼠中,如精子濃度和運動能力等精子質量參數明顯得到改善。與受雌醇酮影響的組相比,MDA水平明顯降低,Gpx和Sod的酶活性在硒治療組中也明顯提高。同樣地,硒治療還適當調節了與凋亡相關基因的相對mRNA表達(Bax和Casp3的表達減少,而Bcl2的表達增加)。有趣的是,經過硒補充後,與血-睾丸屏障相關基因,即Cdh2和Vim的相對mRNA表達也顯著增加[145]。
這些發現和其他幾項相似的研究(請參見表6)提供了合理的證據,顯示硒補充可以改善因不同的實驗/毒性誘導的挑戰而受到影響的動物的生殖效率。從這些證據中可以確定,硒至少部分地通過調節抗氧化平衡和調控與精子生成和類固醇生成相關的某些重要分子機制來發揮其作用。儘管手邊的研究結果令人心動且令人鼓舞,但這些研究的體積仍然不足以做出堅固的建議。因此,未來的研究應該聚焦於闡明通過哪些潛在機制和信號通路,硒可能緩解毒性誘導的損害以及男性的生殖效率。這些研究的結果有望為男性生育能力這一主題開辟新的維度。無論如何,其他最近的研究專注於硒補充對不同實驗性誘發的挑戰的影響,已在表6中進行了總結。
表6 研究表明,硒對於改善暴露於不同實驗/毒性挑戰的男性的生殖效率具有重要意義。
| 動物模型 | 實驗條件/治療方案 | 相關結果 | 參考文獻 |
|---|---|---|---|
| 大鼠 | 使用硒奈米粒子 (0.2 和 0.5 mg/kg/d) 補充,以緩解母鼠暴露於二丁基鄰苯二甲酸酯 (DBP) 造成的未成熟雄性大鼠子代的發育性睾丸毒性。注意:孕鼠從懷孕第12天到出生後第14天使用兩劑量的硒奈米粒子 (0.2 和 0.5 mg/kg/d) 對抗DBP (500 mg/kg/d) 誘導的發育性睾丸毒性。 | 母鼠的硒治療顯著增加了未成熟雄性大鼠子代的Gpx、Sod、Insl3和Mr mRNA表達。睾丸組織中的丙二醛(MDA)和GSH水平也分別顯著減少和增加。此外,組織學評估揭示睾丸實質的損傷也得到了緩解。 | [146] |
| Wistar大鼠 | 鎘暴露的大鼠用硒 (0.35 mg per kg體重) 治療28天。 | 與鎘暴露的大鼠相比,睾丸硒水平、抗氧化酶活性、類固醇激素水平及睾醇合成相關的酶活性均得到了適當的緩解。此外,硒治療至少部分地緩解了鎘對大鼠睾丸結構的損傷。硒治療還調節了關鍵的睾丸損傷相關標記酶,包括LDH、SDH、G6PD、G6Pase、ACP、ALP和AST。 | [147] |
| Kunming老鼠 | 黃曲霉毒素B1暴露的老鼠用無機硒 (0.2 和 0.4 mg/kg) 治療45天。 | 兩劑量的硒治療(0.2 和 0.4 mg/kg)顯著改善了與黃曲霉毒素B1暴露組相比的精子質量參數,如形態、濃度和運動性。活性氧(ROS)、MDA水平顯著下降,Gpx活性提高。硒治療組的血清睾醇水平和睾醇合成酶StAR、P450scc和17β-HSD的蛋白表達也顯著提高。 | [148] |
| 白化大鼠 | 口服deltamethrin暴露的大鼠與硒和維生素E的組合補充劑治療(1.2 mg/kg體重Viteselen®,含有1.67 mg硒酸鈉 + 150 mg維生素E/mL)。 | 硒治療顯著改善了精子的質量特性,提高了睾醇和睾丸GSH的水平,並降低了MDA的水平。同樣,與deltamethrin暴露組相比,硒治療組的精子生成和睾丸實質的組織結構也顯著改善。 | [149] |
| 大鼠 | 用硒奈米粒子 (0.1 mg per kg體重) 治療streptozotocin暴露的糖尿病大鼠。 | 硒治療組顯示出改善的抗氧化狀態和血清睾醇水平。與凋亡相關基因,如Bax和Bcl-2的表達也發生了顯著的變化。組織學評估揭示,硒治療顯著緩解了streptozotocin暴露造成的睾丸損傷,這可以通過大鼠體內精細胞數量的增加來證明。 | [150] |
| Wistar大鼠 | 用超營養性硒 (作者未報告劑量) 治療21天的enrofloxacin暴露的大鼠。 | 硒共同給藥中度改善了睾丸組織中的抗氧化酶活性,並降低了LPO水平。精子參數,如總數、存活率也部分得到改善。 | [151] |
| SD大鼠 | 用硒奈米粒子 (0.5, 1, 2 mg Se/kg體重) 治療14天的硫酸鎳暴露的大鼠。 | 硒治療適當地緩解了Ni暴露大鼠的睾丸損傷。GPX活性在睾丸中得到改善,MDA水平降低。此外,與Ni暴露的大鼠相比,硒治療組的凋亡率顯著降低。觀察到caspase-3陽性細胞的顯著下降。硒治療顯著降低了睾丸中Bak、cytochrome c和caspase-9的mRNA和蛋白表達,並增加了Bcl-2的表達。在使用更高劑量的硒 (2 mg) 的大鼠中,這些效果更為明顯。 | [152] |
| SD大鼠 | 用硒 (1 mg Se/kg) 治療Aroclor 1254暴露的大鼠。此研究中使用了正常和硒缺乏的大鼠。 | 在Aroclor 1254暴露的硒缺乏大鼠中,DNA損傷更為明顯。硒補充劑顯著緩解了正常Aroclor 1254暴露和硒缺乏大鼠精子中的DNA損傷。 | [153] |
| NMRI老鼠 | 用硒 (0.3mg/kg) 治療7天的地塞米松治療的老鼠。 | 硒治療增加了睾丸中Catsper1和Catsper2的mRNA表達。LH的血清水平也有所改善。值得注意的是,Catsper1和Catsper2參與了重要的精子功能。 | [154] |
| Wistar大鼠 | 用無機硒 (0.05, 0.1, 0.2, 和 0.4 mg per kg體重) 補充實驗性的精索靜脈曲張雄性大鼠。 | 精子質量參數、抗氧化狀態得到了顯著改善,與精索靜脈曲張對照大鼠相比,睾丸組織結構的損傷明顯減少,Johnsen的分數也得到了適當的改善。 | [142] |
人體研究 (臨床證據)
在現有的文獻中,有少數的臨床試驗闡述了抗氧化劑補充對男性生育能力的影響。然而,由於受試者的招募存在不一致性和設計的異質性,這些研究的比較變得複雜 [7,155]。在一項關於抗氧化療法對男性次生育能力影響的最近的系統性評估中,Smits 及其同事 [156] 得出結論,應建議次生育夫婦,目前手頭上關於使用抗氧化劑的證據是不確定且不一致的,主要是因為事件率低和整體樣本大小小,研究設計差和隨機化方法不足。這些研究也未報告如活產率和臨床懷孕等關鍵的臨床結果。因此,仍然需要更多數量大且設計得當的隨機安慰劑對照試驗,專注於如懷孕和活產等真正的臨床結果,以清楚地了解抗氧化劑在改善男性次生育能力中的確切意義。有趣的是,在美國進行的一項“特徵明確”的最大的適當能量的臨床試驗中,Steiner 和同事 [157] 示範了組合抗氧化療法 (包含硒 200 μg,詳見表 7) 三個月並不改善174對患有男性因素不孕的夫婦的精子參數和臨床結果 [157]。這些作者還展示了過去的幾項臨床研究/試驗中,已報導抗氧化療法有助於改善精子參數,但被參與者數量少、受試者的異質性、抗氧化劑的種類和非臨床終點所限制。作者進一步主張,他們的研究相對於先前的研究提供了一個較為強有力的證據基礎。無論如何,在這裡我們簡要回顧了一些相關報告,著重於硒(單獨或與其他微量元素結合補充)在男性生育能力和精子參數上的意義。
表格 7:人類研究(2009-2019)涉及硒補充劑以改善男性生育力/生殖狀況/臨床結果。
| 狀況 | 研究類型和地點 | 受試者數量和年齡 | 治療類型和持續時間 | 主要結果 | 參考文獻 |
|---|---|---|---|---|---|
| 被診斷為有精索靜脈曲張並接受次腹股溝靜脈曲張切除術的受試者 | 隨機,單盲臨床試驗(干預 vs 控制組)(伊朗) | n = 60 不孕男子 年齡:未報告 | 口服補充硒(200 μg)、葉酸(5 mg)和維生素E(400IU)(6個月) | 與控制組相比,精子參數有所改善。 | Zadeh 等人。[163] |
| 男性因素不孕症患者 | 多中心,雙盲,隨機,安慰劑對照試驗,於八個美國生育中心進行(美國) | n = 174對夫婦 男性年齡:未報告 | 500 mg 維生素C,2000IU 維生素D3,400IU 維生素E,1 mg 葉酸,20 mg 鋅,200 μg 硒,和 1000 mg L-肉酸(3個月) | 精液質量參數或DNA片段沒有改善。 在體內受孕率也沒有改善。 | Steiner 等人(2018)[157] |
| 不孕男子 | 縱向研究(伊拉克) | n = 12 年齡:未報告 | 50 μg 硒(3個月) | 改善了精子數量、活力、生存能力、精子形態和射精量。 | Mossa 等人(2018)[164] |
| 原因不明的精子運動性和形態異常不孕病人 | 前瞻性開放標籤研究(意大利) | n = 114(96 完成研究) 年齡:21-46 歲 | 組合治療,包括硒 50 mcg + L-肉酸 145 mg + 乙酰-L-肉酸 64 mg + 果糖 250 mg + 檸檬酸 50 mg + 輔酶Q10 20 mg + 鋅 10 mg + 抗壞血酸 90 mg + 鋰硫酸鈷胺 1.5 mcg + 葉酸 200 mcg(4個月) | 觀察到精子參數(如前向運動性)的改善,治療得到了良好的忍受。 16名患者在研究期間達到了懷孕。 | Busetto 等人(2012)[165] |
| 慢性攝護腺炎 | 前瞻性開放標籤研究(意大利) | n = 60 年齡:30-55 歲 | 硒 82.3 μg + 蕃茄紅素(1.5 mg)+ 表兒茶素酸酯(250 mg)+ 鞣花酸(250 mg)+ 鋅(20 mg)(30受試者)vs 無治療(30受試者)(6個月) | 觀察到改善的精子質量參數(運動性和形態)改善白細胞精子症和慢性攝護腺炎症狀指數。 | Lombardo 等人(2012)[166] |
| 特發性精子運動性和形態異常 | 前瞻性單臂研究(伊朗) | n = 690 年齡:20-45 歲 | 200 μg/d L-硒甲基蛋氨酸 + 400 IU/d 維E(3個月) | 觀察到精子運動性、形態和懷孕率的改善。 | Moslemi 和 Tavanbakhsh(2011)[167] |
| 健康男性 | 雙盲 RCT(美國) | n = 42 年齡:18-45 歲 | 300 μg/d 硒-酵母或安慰劑(11個月) | 沒有觀察到精液參數的影響。 | Hawkes 等人(2009)[162] |
| 特發性精子運動性和形態異常 | 雙盲 RCT(伊朗) | n = 468 年齡:25-48 歲 | 200 μg 硒/d(116受試者),或 600 mg NAC/d(118受試者),或 200 μg 硒+ 600 mg NAC/d(116受試者)或安慰劑(118受試者)(6個月) | 觀察到改善的精子數量、運動性和形態(在硒 + NAC和硒單獨組) | Safarinejad 和 Safarinejad(2009)[62] |
在28位土耳其男性中,患有特發性不孕症,報導顯示精子受到過度的氧化損害,儘管精液質量參數被確定符合世界衛生組織的標準。與精子中ROS相關DNA損傷的增加一起,特發性不孕男性中MDA、蛋白質羰基和硝基酪氨酸的水平也增加了[158]。在特發性不孕男性的精液中觀察到這些增加的氧化壓力參數,也表明他們的生殖器官無法抵抗氧化壓力。因此,這很可能會增加患有特發性不孕症的受試者的生殖能力減弱[158]。最近報導,Se治療(5μg/mL的硒酸鈉)顯著改善了42位臨床健康的伊朗男性的冷凍保存精液的精子質量和生存能力[159]。與未經治療的對照組相比,Se治療組中正常形態和運動性精子的百分比得到了充分的改善。精子[159]中也明顯減少了解凍後的DNA損傷。同樣,在另一項涉及50名精子運動性和形態異常男性的最近研究中,Ghafarizadeh等人[160]報導,在測試組中(用2μg/mL的Se在37°C下處理兩個,四個和六個小時),精子質量參數(如運動性、生存能力和粒線體膜電位)的評分顯著較高。在Se補充組中觀察到MDA和DNA片段的顯著較低水平。這些作者得出結論,體外Se補充可能會通過保持酶和抗氧化防禦機制處於最佳狀態,保護精子免受ROS在精子取樣期間的有害影響[160]。Scott等人[161]之前的研究結果也支持了這些發現,他們報導,經過每天補充100μg Se三個月後,一組次生育男性的精子運動性顯著增強。在接受Se補充的人中,11%的男性達到了父親的身份,而安慰劑組中沒有人[161]。然而,也有報導說,高劑量的Se補充劑(約每天300μg)也被報導會減少11名健康男性的精子運動性32%。即使這種精子運動性的減少並不必然預示生育力的下降,但健康人群中硒補充的增加頻率引起了進一步研究這種潛在副作用的需求,以充分闡明這種潛在副作用[129]。除了上述證據,我們還總結了(表7)主要臨床試驗的結果(2009-2019),研究了硒在男性精子參數和生育力方面的作用。值得一提的是,唯一一項(排除了最近有關Se組合效果的研究)沒有任何積極Se補充效果的研究(300μg/d Se-酵母vs安慰劑;[162])是在美國進行的,那裡沒有廣泛的Se缺乏。然而,考慮到世界不同地區Se攝入量的差異,以及土壤Se水平的變化和個人食物中Se含量的差異,以及其他混淆因素,進行更多具有充分效能的多中心隨機干預試驗(與對照組)在已知Se缺乏的大型人群隊列中將非常重要。然而,在進行這種隨機試驗之前,應仔細確定並優化Se補充的類型和持續時間(無論是與否其他抗氧化微量營養素)。這些仔細進行的試驗實際上有可能讓我們清楚了解,是否應鼓勵增加硒補充劑的劑量,以改善男性的生育結果。無論如何,在設計男性的膳食硒補充試驗時,應始終仔細考慮硒的U型反應。
討論與展望
本綜述聚焦於硒和硒蛋白在整體男性生殖能力及相關不足方面的意義和可能角色,涵蓋動物和人類模型。通過最佳飲食維持生理硒濃度,或通過硒補充劑來達成,不僅是改善男女生殖效率的基本要求,也是保護動物和人類整體健康的重要手段。
從過去研究(動物和人類)的觀察中明顯看出,硒對於精子生成和男性生育能力來說是基本必需的,可能是因為它在調節抗氧化防禦機制、其他重要生物途徑和氧化還原敏感轉錄因子中的重要作用。在男性領域,越來越多的文獻闡明了可能的分子機制,相關證據表明硒在精子中有結構性作用,這是通過一種特殊和典型的硒蛋白,即GPX4,來媒介的,並影響精子運動性、染色質完整性和生育率。此外,適當地運送硒以合成睪丸中某些硒蛋白對於正確的精子生成和類固醇生物合成非常重要;因此,其缺乏或過量補充可能會中止正常的精子生成過程,並在很大程度上影響整體生殖效率,甚至可能導致男性不孕。然而,考慮到主流文獻中的證據,建議進行更多研究,以闡明兩種特殊和典型的硒蛋白,即GPX4和SELENOP在男性生殖功能中所起的其他作用。此外,尋找其他生物學相關硒蛋白可能調節的其他假設機制的闡明同樣重要,應包括在未來研究的範疇中。例如,最近已經證明,硒蛋白U(在小鼠和人類中缺失)在雞SC的PI3K-AKT-mTOR信號通路中有影響,並可能在精子生成過程中發揮新的調節作用[105]。類似的研究應專注於其他硒蛋白(即SELNOK、M、S、V、W等)在哺乳動物對應物中的假設調節作用,也應該得出吸引人的發現和結果,這將更多地幫助我們了解硒和硒蛋白的生物學作用,以及它們與哺乳動物男性的生殖功能的關聯。
就硒對男性生育和生殖的影響而言,一些臨床試驗的發現也支持了硒補充劑在改善男性生殖不足方面的影響。然而,這些研究的質量和規模不足且不一致,無法得出堅定的結論;因此,期待更多研究以進一步驗證這些發現,並概述任何治療方案(硒補充)以改善男性生育。有趣的是,即使在不孕夫婦中很少診斷出硒缺乏,間接證據也表明,進一步診斷硒狀態是有意義的。因此,應該擴展尋找可靠和強健的診斷生物標記物,這將有助於醫生診斷與男性硒缺乏相關的不孕。然而,考慮到钟形反應曲線[168]和潛在的不良反應,如在“硒和維生素E癌症預防試驗(SELECT)”中觀察到的,在確定硒的最佳劑量時應非常小心;特別是,應該非常小心地評估具有足夠或高硒狀態的受試者。
此外,專注於評估硒在不同實驗性誘導/毒性相關狀況及其對男性生殖效率的不利影響的研究結果,以及闡明低硒飲食對後代生育能力可能的基因毒性效應的研究也是吸引人的,但這類研究的數量仍然非常低,因此,未來需要進一步考慮。總的來看,有關動物和人類生殖中硒生物學的幾個問題仍然沒有得到解答。對這些科學問題的深入考慮以及進一步理解硒和硒蛋白的可能功能,應為可能的硒對男性生殖能力和健康的影響提供更多解釋。
參考文獻:
1. Oldfield J.E. The two faces of selenium. J. Nutr. 1987;117:2002–2008. doi: 10.1093/jn/117.12.2002. [PubMed] [CrossRef] [Google Scholar]
2. Schwarz K., Foltz C.M. Selenium as an integral part of factor 3 against dietary necrotic liver degeneration. J. Am. Chem. Soc. 1957;79:3292–3293. doi: 10.1021/ja01569a087. [CrossRef] [Google Scholar]
3. O’Dell B.L., Sunde R.A. Handbook of Nutritionally Essential Mineral Elements. CRC Press; New York, NY, USA: Basel, Switzerland: Hong Kong, China: 1997. [Google Scholar]
4. Ceko M.J., O’leary S., Harris H.H., Hummitzsch K., Rodgers R.J. Trace elements in ovaries: Measurement and physiology. Biol. Reprod. 2016;94:86. doi: 10.1095/biolreprod.115.137240. [PubMed] [CrossRef] [Google Scholar]
5. Xiong X., Lan D., Li J., Lin Y., Li M. Selenium supplementation during in vitro maturation enhances meiosis and developmental capacity of yak oocytes. Anim. Sci. J. 2018;89:298–306. doi: 10.1111/asj.12894. [PubMed] [CrossRef] [Google Scholar]
6. Hedaoo M., Khllare K., Meshram M., Sahatpure S., Patil M. Study of some serum trace minerals in cyclic and non-cyclic surti buffaloes. Vet. World. 2008;1:71. [Google Scholar]
7. Mirone M., Giannetta E., Isidori A. Selenium and reproductive function. A systematic review. J. Endocrinol. Investig. 2013;36:28–36. [PubMed] [Google Scholar]
8. Pappas A., Zoidis E., Surai P., Zervas G. Selenoproteins and maternal nutrition. Comp. Biochem. Physiol. Part B Biochem. Mol. Biol. 2008;151:361–372. doi: 10.1016/j.cbpb.2008.08.009. [PubMed] [CrossRef] [Google Scholar]
9. Foresta C., Flohé L., Garolla A., Roveri A., Ursini F., Maiorino M. Male fertility is linked to the selenoprotein phospholipid hydroperoxide glutathione peroxidase. Biol. Reprod. 2002;67:967–971. doi: 10.1095/biolreprod.102.003822. [PubMed] [CrossRef] [Google Scholar]
10. Kommisrud E., Østerås O., Vatn T. Blood selenium associated with health and fertility in Norwegian dairy herds. Acta Vet. Scand. 2005;46:229. doi: 10.1186/1751-0147-46-229. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
11. Behne D., Höfer T., von Berswordt-Wallrabe R., Elger W. Selenium in the testis of the rat: Studies on its regulation and its importance for the organism. J. Nutr. 1982;112:1682–1687. doi: 10.1093/jn/112.9.1682. [PubMed] [CrossRef] [Google Scholar]
12. Behne D., Weiler H., Kyriakopoulos A. Effects of selenium deficiency on testicular morphology and function in rats. J. Reprod. Fertil. 1996;106:291–297. doi: 10.1530/jrf.0.1060291. [PubMed] [CrossRef] [Google Scholar]
13. Flohe L. Selenium in mammalian spermiogenesis. Biol. Chem. 2007;388:987–995. doi: 10.1515/BC.2007.112. [PubMed] [CrossRef] [Google Scholar]
14. Ahsan U., Kamran Z., Raza I., Ahmad S., Babar W., Riaz M., Iqbal Z. Role of selenium in male reproduction—A review. Anim. Reprod. Sci. 2014;146:55–62. doi: 10.1016/j.anireprosci.2014.01.009. [PubMed] [CrossRef] [Google Scholar]
15. Irvine D.S. Glutathione as a treatment for male infertility. Rev. Reprod. 1996;1:6–12. doi: 10.1530/ror.0.0010006. [PubMed] [CrossRef] [Google Scholar]
16. Letavayová L., Vlčková V., Brozmanová J. Selenium: From cancer prevention to DNA damage. Toxicology. 2006;227:1–14. doi: 10.1016/j.tox.2006.07.017. [PubMed] [CrossRef] [Google Scholar]
17. Schrauzer G.N. Selenomethionine: A review of its nutritional significance, metabolism and toxicity. J. Nutr. 2000;130:1653–1656. doi: 10.1093/jn/130.7.1653. [PubMed] [CrossRef] [Google Scholar]
18. Rayman M.P., Infante H.G., Sargent M. Food-chain selenium and human health: Spotlight on speciation. Br. J. Nutr. 2008;100:238–253. doi: 10.1017/S0007114508922522. [PubMed] [CrossRef] [Google Scholar]
19. Burk R.F., Hill K.E. Regulation of selenium metabolism and transport. Annu. Rev. Nutr. 2015;35:109–134. doi: 10.1146/annurev-nutr-071714-034250. [PubMed] [CrossRef] [Google Scholar]
20. Surai P.F., Fisinin V.I. Selenium in Pig Nutrition and reproduction: Boars and semen quality—A Review. Asian-Australas. J. Anim. Sci. 2015;28:730. doi: 10.5713/ajas.14.0593. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
21. Surai P.F., Fisinin V.I. Selenium in livestock and other domestic animals. In: Hatfield D., Schweizer U., Tsuji P., Gladyshev V., editors. Selenium. Springer; Berlin/Heidelberg, Germany: 2016. pp. 595–606. [Google Scholar]
22. Rayman M.P. The use of high-selenium yeast to raise selenium status: How does it measure up? Br. J. Nutr. 2004;92:557–573. doi: 10.1079/BJN20041251. [PubMed] [CrossRef] [Google Scholar]
23. Dalto D., Matte J.-J. Pyridoxine (vitamin B6) and the glutathione peroxidase system; a link between one-carbon metabolism and antioxidation. Nutrients. 2017;9:189. doi: 10.3390/nu9030189. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
24. Dalto D.B., Audet I., Lapointe J., Matte J.J. The importance of pyridoxine for the impact of the dietary selenium sources on redox balance, embryo development, and reproductive performance in gilts. J. Trace Elem. Med. Biol. 2016;34:79–89. doi: 10.1016/j.jtemb.2016.01.001. [PubMed] [CrossRef] [Google Scholar]
25. Dalto D.B., Roy M., Audet I., Palin M.-F., Guay F., Lapointe J., Matte J.J. Interaction between vitamin B6 and source of selenium on the response of the selenium-dependent glutathione peroxidase system to oxidative stress induced by oestrus in pubertal pig. J. Trace Elem. Med. Biol. 2015;32:21–29. doi: 10.1016/j.jtemb.2015.05.002. [PubMed] [CrossRef] [Google Scholar]
26. Fairweather-Tait S.J., Collings R., Hurst R. Selenium bioavailability: Current knowledge and future research requirements. Am. J. Clin. Nutr. 2010;91:1484S–1491S. doi: 10.3945/ajcn.2010.28674J. [PubMed] [CrossRef] [Google Scholar]
27. Rayman M.P. Selenium and human health. Lancet. 2012;379:1256–1268. doi: 10.1016/S0140-6736(11)61452-9. [PubMed] [CrossRef] [Google Scholar]
28. Xia Y., Hill K.E., Byrne D.W., Xu J., Burk R.F. Effectiveness of selenium supplements in a low-selenium area of China. Am. J. Clin. Nutr. 2005;81:829–834. doi: 10.1093/ajcn/81.4.829. [PubMed] [CrossRef] [Google Scholar]
29. Swanson C., Patterson B., Levander O., Veillon C., Taylor P., Helzlsouer K., McAdam P., Zech L. Human [74Se] selenomethionine metabolism: A kinetic model. Am. J. Clin. Nutr. 1991;54:917–926. doi: 10.1093/ajcn/54.5.917. [PubMed] [CrossRef] [Google Scholar]
30. Huerta V.D., Sánchez M.L.F., Sanz-Medel A. Quantitative selenium speciation in cod muscle by isotope dilution ICP-MS with a reaction cell: Comparison of different reported extraction procedures. J. Anal. At. Spectrom. 2004;19:644–648. doi: 10.1039/B313826G. [CrossRef] [Google Scholar]
31. Steen A., Strøm T., Bernhoft A. Organic selenium supplementation increased selenium concentrations in ewe and newborn lamb blood and in slaughter lamb meat compared to inorganic selenium supplementation. Acta Vet. Scand. 2008;50:7. doi: 10.1186/1751-0147-50-7. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
32. Juniper D.T., Phipps R.H., Ramos-Morales E., Bertin G. Effect of dietary supplementation with selenium-enriched yeast or sodium selenite on selenium tissue distribution and meat quality in beef cattle. J. Anim. Sci. 2008;86:3100–3109. doi: 10.2527/jas.2007-0595. [PubMed] [CrossRef] [Google Scholar]
33. Deagen J., Butler J., Beilstein M., Whanger P. Effects of dietary selenite, selenocystine and selenomethionine on selenocysteine lyase and glutathione peroxidase activities and on selenium levels in rat tissues. J. Nutr. 1987;117:91–98. doi: 10.1093/jn/117.1.91. [PubMed] [CrossRef] [Google Scholar]
34. Behne D., Alber D., Kyriakopoulos A. Long-term selenium supplementation of humans: Selenium status and relationships between selenium concentrations in skeletal muscle and indicator materials. J. Trace Elem. Med. Biol. 2010;24:99–105. doi: 10.1016/j.jtemb.2009.12.001. [PubMed] [CrossRef] [Google Scholar]
35. Suzuki K.T., Doi C., Suzuki N. Metabolism of 76Se-methylselenocysteine compared with that of 77Se-selenomethionine and 82Se-selenite. Toxicol. Appl. Pharmacol. 2006;217:185–195. doi: 10.1016/j.taap.2006.09.006. [PubMed] [CrossRef] [Google Scholar]
36. EFSA Selenium-enriched yeast as source for selenium added for nutritional purposes in foods for particular nutritional uses and foods (including food supplements) for the general population-Scientific Opinion of the Panel on Food Additives. EFSA J. 2008;766:1–42. doi: 10.2903/j.efsa.2008.766. [CrossRef] [Google Scholar]
37. Yamashita Y., Yamashita M. Identification of a novel selenium-containing compound, selenoneine, as the predominant chemical form of organic selenium in the blood of bluefin tuna. J. Biol. Chem. 2010;285:18134–18138. doi: 10.1074/jbc.C110.106377. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
38. Kotrebai M., Birringer M., Tyson J.F., Block E., Uden P.C. Selenium speciation in enriched and natural samples by HPLC-ICP-MS and HPLC-ESI-MS with perfluorinated carboxylic acid ion-pairing agents. Analyst. 2000;125:71–78. doi: 10.1039/a906320j. [PubMed] [CrossRef] [Google Scholar]
39. Ip C., Birringer M., Block E., Kotrebai M., Tyson J.F., Uden P.C., Lisk D.J. Chemical speciation influences comparative activity of selenium-enriched garlic and yeast in mammary cancer prevention. J. Agric. Food Chem. 2000;48:2062–2070. doi: 10.1021/jf000051f. [PubMed] [CrossRef] [Google Scholar]
40. Cappon C.J., Smith J.C. Chemical form and distribution of mercury and selenium in edible seafood. J. Anal. Toxicol. 1982;6:10–21. doi: 10.1093/jat/6.1.10. [PubMed] [CrossRef] [Google Scholar]
41. JohnáLewis D. Investigation of selenium speciation in in vitro gastrointestinal extracts of cooked cod by high-performance liquid chromatography–inductively coupled plasma mass spectrometry and electrospray mass spectrometry. J. Anal. At. Spectrom. 1996;11:1177–1182. [Google Scholar]
42. Bergdahl I.A. Fractionation of soluble selenium compounds from fish using size-exclusion chromatography with on-line detection by inductively coupled plasma mass spectrometry. Analyst. 1999;124:1435–1438. doi: 10.1039/a904024b. [PubMed] [CrossRef] [Google Scholar]
43. Qazi I.H., Angel C., Yang H., Pan B., Zoidis E., Zeng C.J., Han H., Zhou G.B. Selenium, Selenoproteins, and Female Reproduction: A Review. Molecules. 2018;23:3053. doi: 10.3390/molecules23123053. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
44. Rayman M.P. The importance of selenium to human health. Lancet. 2000;356:233–241. doi: 10.1016/S0140-6736(00)02490-9. [PubMed] [CrossRef] [Google Scholar]
45. Yim S.H., Clish C.B., Gladyshev V.N. Selenium Deficiency Is Associated with Pro-longevity Mechanisms. Cell Rep. 2019;27:2785–2797. doi: 10.1016/j.celrep.2019.05.001. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
46. Labunskyy V.M., Hatfield D.L., Gladyshev V.N. Selenoproteins: Molecular pathways and physiological roles. Physiol. Rev. 2014;94:739–777. doi: 10.1152/physrev.00039.2013. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
47. Gladyshev V.N., Arnér E.S., Berry M.J., Brigelius-Flohé R., Bruford E.A., Burk R.F., Carlson B.A., Castellano S., Chavatte L., Conrad M. Selenoprotein gene nomenclature. J. Biol. Chem. 2016;291:24036–24040. doi: 10.1074/jbc.M116.756155. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
48. Kryukov G.V., Castellano S., Novoselov S.V., Lobanov A.V., Zehtab O., Guigó R., Gladyshev V.N. Characterization of mammalian selenoproteomes. Science. 2003;300:1439–1443. doi: 10.1126/science.1083516. [PubMed] [CrossRef] [Google Scholar]
49. Touat-Hamici Z., Legrain Y., Bulteau A.-L., Chavatte L. Selective up-regulation of human selenoproteins in response to oxidative stress. J. Biol. Chem. 2014;289:14750–14761. doi: 10.1074/jbc.M114.551994. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
50. Reeves M., Hoffmann P. The human selenoproteome: Recent insights into functions and regulation. Cell. Mol. Life Sci. 2009;66:2457–2478. doi: 10.1007/s00018-009-0032-4. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
51. Sunde R.A., Raines A.M., Barnes K.M., Evenson J.K. Selenium status highly regulates selenoprotein mRNA levels for only a subset of the selenoproteins in the selenoproteome. Biosci. Rep. 2009;29:329–338. doi: 10.1042/BSR20080146. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
52. Hammad G., Legrain Y., Touat-Hamici Z., Duhieu S., Cornu D., Bulteau A.-L., Chavatte L. Interplay between selenium levels and replicative senescence in WI-38 human fibroblasts: A proteomic approach. Antioxidants. 2018;7:19. doi: 10.3390/antiox7010019. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
53. Carlson B.A., Novoselov S.V., Kumaraswamy E., Lee B.J., Anver M.R., Gladyshev V.N., Hatfield D.L. Specific excision of the selenocysteine tRNA [Ser] Sec (Trsp) gene in mouse liver demonstrates an essential role of selenoproteins in liver function. J. Biol. Chem. 2004;279:8011–8017. doi: 10.1074/jbc.M310470200. [PubMed] [CrossRef] [Google Scholar]
54. Schomburg L., Schweizer U., Holtmann B., Flohé L., Sendtner M., Köhrle J. Gene disruption discloses role of selenoprotein P in selenium delivery to target tissues. Biochem. J. 2003;370:397–402. doi: 10.1042/bj20021853. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
55. Dikiy A., Novoselov S.V., Fomenko D.E., Sengupta A., Carlson B.A., Cerny R.L., Ginalski K., Grishin N.V., Hatfield D.L., Gladyshev V.N. SelT, SelW, SelH, and Rdx12: Genomics and molecular insights into the functions of selenoproteins of a novel thioredoxin-like family. Biochemistry. 2007;46:6871–6882. doi: 10.1021/bi602462q. [PubMed] [CrossRef] [Google Scholar]
56. Zoidis E., Pappas A. The health effects of selenoproteins. In: Aomori C., Hokkaido M., editors. Selenium: Sources, Functions and Health Effects. Nova Science Publishers; New York, NY, USA: 2012. [Google Scholar]
57. Conrad M., Schweizer U. Mouse Models that Target Individual Selenoproteins. In: Hatfield D.L., Schweizer U., Tsuji P.A., Gladyshev V.N., editors. Selenium: Its Molecular Biology and Role in Human Health. Springer; New York, NY, USA: 2016. pp. 567–578. [Google Scholar]
58. Riese C., Michaelis M., Mentrup B., Gotz F., Kohrle J., Schweizer U., Schomburg L. Selenium-dependent pre-and posttranscriptional mechanisms are responsible for sexual dimorphic expression of selenoproteins in murine tissues. Endocrinology. 2006;147:5883–5892. doi: 10.1210/en.2006-0689. [PubMed] [CrossRef] [Google Scholar]
59. Beckett G.J., Arthur J.R. Selenium and endocrine systems. J. Endocrinol. 2005;184:455–465. doi: 10.1677/joe.1.05971. [PubMed] [CrossRef] [Google Scholar]
60. Knapen M.F., Zusterzeel P.L., Peters W.H., Steegers E.A. Glutathione and glutathione-related enzymes in reproduction: A review. Eur. J. Obstet. Gynecol. Reprod. Biol. 1999;82:171–184. doi: 10.1016/S0301-2115(98)00242-5. [PubMed] [CrossRef] [Google Scholar]
61. Ursini F., Heim S., Kiess M., Maiorino M., Roveri A., Wissing J., Flohé L. Dual function of the selenoprotein PHGPx during sperm maturation. Science. 1999;285:1393–1396. doi: 10.1126/science.285.5432.1393. [PubMed] [CrossRef] [Google Scholar]
62. Safarinejad M.R., Safarinejad S. Efficacy of selenium and/or N-acetyl-cysteine for improving semen parameters in infertile men: A double-blind, placebo controlled, randomized study. J. Urol. 2009;181:741–751. doi: 10.1016/j.juro.2008.10.015. [PubMed] [CrossRef] [Google Scholar]
63. Imai H., Hirao F., Sakamoto T., Sekine K., Mizukura Y., Saito M., Kitamoto T., Hayasaka M., Hanaoka K., Nakagawa Y. Early embryonic lethality caused by targeted disruption of the mouse PHGPx gene. Biochem. Biophys. Res. Commun. 2003;305:278–286. doi: 10.1016/S0006-291X(03)00734-4. [PubMed] [CrossRef] [Google Scholar]
64. Conrad M., Moreno S., Sinowatz F., Ursini F., Kölle S., Roveri A., Brielmeier M., Wurst W., Maiorino M., Bornkamm G. The nuclear form of phospholipid hydroperoxide glutathione peroxidase is a protein thiol peroxidase contributing to sperm chromatin stability. Mol. Cell. Biol. 2005;25:7637–7644. doi: 10.1128/MCB.25.17.7637-7644.2005. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
65. Chabory E., Damon C., Lenoir A., Henry-Berger J., Vernet P., Cadet R., Saez F., Drevet J. Mammalian glutathione peroxidases control acquisition and maintenance of spermatozoa integrity 1. J. Anim. Sci. 2010;88:1321–1331. doi: 10.2527/jas.2009-2583. [PubMed] [CrossRef] [Google Scholar]
66. Schneider M., Förster H., Boersma A., Seiler A., Wehnes H., Sinowatz F., Neumüller C., Deutsch M.J., Walch A., de Angelis M.H. Mitochondrial glutathione peroxidase 4 disruption causes male infertility. FASEB J. 2009;23:3233–3242. doi: 10.1096/fj.09-132795. [PubMed] [CrossRef] [Google Scholar]
67. Imai H., Suzuki K., Ishizaka K., Ichinose S., Oshima H., Okayasu I., Emoto K., Umeda M., Nakagawa Y. Failure of the expression of phospholipid hydroperoxide glutathione peroxidase in the spermatozoa of human infertile males. Biol. Reprod. 2001;64:674–683. doi: 10.1095/biolreprod64.2.674. [PubMed] [CrossRef] [Google Scholar]
68. Imai H., Hakkaku N., Iwamoto R., Suzuki J., Suzuki T., Tajima Y., Konishi K., Minami S., Ichinose S., Ishizaka K. Depletion of selenoprotein GPx4 in spermatocytes causes male infertility in mice. J. Biol. Chem. 2009;284:32522–32532. doi: 10.1074/jbc.M109.016139. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
69. Meseguer M., Maria J., Simón C., Pellicer A., Remohí J., Garrido N. Effect of sperm glutathione peroxidases 1 and 4 on embryo asymmetry and blastocyst quality in oocyte donation cycles. Fertil. Steril. 2006;86:1376–1385. doi: 10.1016/j.fertnstert.2006.03.053. [PubMed] [CrossRef] [Google Scholar]
70. Parillo F., Sylla L., Palombi C., Monaci M., Stradaioli G. Immunocytochemical Localisation of Phospholipid Hydroperoxide Glutathione Peroxidase in Bull’s Spermatogenic Cells. Ital. J. Anim. Sci. 2014;13:3483. doi: 10.4081/ijas.2014.3483. [CrossRef] [Google Scholar]
71. Olson G.E., Winfrey V.P., NagDas S.K., Hill K.E., Burk R.F. Apolipoprotein E receptor-2 (ApoER2) mediates selenium uptake from selenoprotein P by the mouse testis. J. Biol. Chem. 2007;282:12290–12297. doi: 10.1074/jbc.M611403200. [PubMed] [CrossRef] [Google Scholar]
72. Hill K.E., Zhou J., McMahan W.J., Motley A.K., Atkins J.F., Gesteland R.F., Burk R.F. Deletion of selenoprotein P alters distribution of selenium in the mouse. J. Biol. Chem. 2003;278:13640–13646. doi: 10.1074/jbc.M300755200. [PubMed] [CrossRef] [Google Scholar]
73. Kehr S., Malinouski M., Finney L., Vogt S., Labunskyy V.M., Kasaikina M.V., Carlson B.A., Zhou Y., Hatfield D.L., Gladyshev V.N. X-ray fluorescence microscopy reveals the role of selenium in spermatogenesis. J. Mol. Biol. 2009;389:808–818. doi: 10.1016/j.jmb.2009.04.024. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
74. Noblanc A., Kocer A., Chabory E., Vernet P., Saez F., Cadet R., Conrad M., Drevet J.R. Glutathione peroxidases at work on epididymal spermatozoa: An example of the dual effect of reactive oxygen species on mammalian male fertilizing ability. J. Androl. 2011;32:641–650. doi: 10.2164/jandrol.110.012823. [PubMed] [CrossRef] [Google Scholar]
75. Boitani C., Puglisi R. Molecular Mechanisms in Spermatogenesis. Springer; Berlin/Heidelberg, Germany: 2009. Selenium, a key element in spermatogenesis and male fertility; pp. 65–73. [PubMed] [Google Scholar]
76. Su D., Novoselov S.V., Sun Q.-A., Moustafa M.E., Zhou Y., Oko R., Hatfield D.L., Gladyshev V.N. Mammalian selenoprotein thioredoxin-glutathione reductase roles in disulfide bond formation and sperm maturation. J. Biol. Chem. 2005;280:26491–26498. doi: 10.1074/jbc.M503638200. [PubMed] [CrossRef] [Google Scholar]
77. Michaelis M., Gralla O., Behrends T., Scharpf M., Endermann T., Rijntjes E., Pietschmann N., Hollenbach B., Schomburg L. Selenoprotein P in seminal fluid is a novel biomarker of sperm quality. Biochem. Biophys. Res. Commun. 2014;443:905–910. doi: 10.1016/j.bbrc.2013.12.067. [PubMed] [CrossRef] [Google Scholar]
78. Renko K., Werner M., Renner-Muller I., Cooper T.G., Yeung C.H., Hollenbach B., Scharpf M., Kohrle J., Schomburg L., Schweizer U. Hepatic selenoprotein P (SePP) expression restores selenium transport and prevents infertility and motor-incoordination in Sepp-knockout mice. Biochem. J. 2008;409:741–749. doi: 10.1042/BJ20071172. [PubMed] [CrossRef] [Google Scholar]
79. Olson G.E., Winfrey V.P., NagDas S.K., Hill K.E., Burk R.F. Selenoprotein P is required for mouse sperm development. Biol. Reprod. 2005;73:201–211. doi: 10.1095/biolreprod.105.040360. [PubMed] [CrossRef] [Google Scholar]
80. Turanov A.A., Malinouski M., Gladyshev V.N. Selenium and male reproduction. In: Hatfield D.L., Berry M.J., Gladyshev V.N., editors. Selenium: Its Molecular Biology and Role in Human Health. Springer; New York, NY, USA: 2012. pp. 409–417. [Google Scholar]
81. Behne D., Duk M., Elger W. Selenium content and glutathione peroxidase activity in the testis of the maturing rat. J. Nutr. 1986;116:1442–1447. doi: 10.1093/jn/116.8.1442. [PubMed] [CrossRef] [Google Scholar]
82. Nishimura K., Matsumiya K., Tsujimura A., Koga M., Kitamura M., Okuyama A. Association of selenoprotein P with testosterone production in cultured Leydig cells. Arch. Androl. 2001;47:67–76. doi: 10.1080/01485010152104026. [PubMed] [CrossRef] [Google Scholar]
83. Koga M., Tanaka H., Yomogida K., Tsuchida J., Uchida K., Kitamura M., Sakoda S., Matsumiya K., Okuyama A., Nishimune Y. Expression of selenoprotein-P messenger ribonucleic acid in the rat testis. Biol. Reprod. 1998;58:261–265. doi: 10.1095/biolreprod58.1.261. [PubMed] [CrossRef] [Google Scholar]
84. Oluboyo A., Adijeh R., Onyenekwe C., Oluboyo B., Mbaeri T., Odiegwu C., Chukwuma G., Onwuasoanya U. Relationship between serum levels of testosterone, zinc and selenium in infertile males attending fertility clinic in Nnewi, south east Nigeria. Afr. J. Med. Med. Sci. 2012;41:51–54. [PubMed] [Google Scholar]
85. Villaverde A.I.S., Fioratti E.G., Ramos R.S., Neves R.C., Ferreira J.C.P., Cardoso G.S., Padilha P.M., Lopes M.D. Blood and seminal plasma concentrations of selenium, zinc and testosterone and their relationship to sperm quality and testicular biometry in domestic cats. Anim. Reprod. Sci. 2014;150:50–55. doi: 10.1016/j.anireprosci.2014.08.004. [PubMed] [CrossRef] [Google Scholar]
86. Richards J., Hallford D., Duff G. Serum luteinizing hormone, testosterone, and thyroxine and growth responses of ram lambs fed locoweed (Oxvtropis sericea) and treated with vitamin e/selenium. Theriogenology. 1999;52:1055–1066. doi: 10.1016/S0093-691X(99)00194-6. [PubMed] [CrossRef] [Google Scholar]
87. Shi L., Zhang C., Yue W., Shi L., Zhu X., Lei F. Short-term effect of dietary selenium-enriched yeast on semen parameters, antioxidant status and Se concentration in goat seminal plasma. Anim. Feed Sci. Technol. 2010;157:104–108. doi: 10.1016/j.anifeedsci.2010.02.006. [CrossRef] [Google Scholar]
88. Ren X.-M., Wang G.-G., Xu D.-Q., Luo K., Liu Y.-X., Zhong Y.-H., Cai Y.-Q. The protection of selenium on cadmium-induced inhibition of spermatogenesis via activating testosterone synthesis in mice. Food Chem. Toxicol. 2012;50:3521–3529. doi: 10.1016/j.fct.2012.07.021. [PubMed] [CrossRef] [Google Scholar]
89. Shi L., Song R., Yao X., Ren Y. Effects of selenium on the proliferation, apoptosis and testosterone production of sheep Leydig cells in vitro. Theriogenology. 2017;93:24–32. doi: 10.1016/j.theriogenology.2017.01.022. [PubMed] [CrossRef] [Google Scholar]
90. Liu H., Li X., Qin F., Huang K. Selenium suppresses oxidative-stress-enhanced vascular smooth muscle cell calcification by inhibiting the activation of the PI3K/AKT and ERK signaling pathways and endoplasmic reticulum stress. JBIC J. Biol. Inorg. Chem. 2014;19:375–388. doi: 10.1007/s00775-013-1078-1. [PubMed] [CrossRef] [Google Scholar]
91. Shi L., Song R., Yao X., Duan Y., Ren Y., Zhang C., Yue W., Lei F. Effects of maternal dietary selenium (Se-enriched yeast) on testis development, testosterone level and testicular steroidogenesis-related gene expression of their male kids in Taihang Black Goats. Theriogenology. 2018;114:95–102. doi: 10.1016/j.theriogenology.2018.03.035. [PubMed] [CrossRef] [Google Scholar]
92. Cerny K., Garbacik S., Skees C., Burris W., Matthews J., Bridges P. Gestational form of selenium in free-choice mineral mixes affects transcriptome profiles of the neonatal calf testis, including those of steroidogenic and spermatogenic pathways. Biol. Trace Elem. Res. 2016;169:56–68. doi: 10.1007/s12011-015-0386-4. [PubMed] [CrossRef] [Google Scholar]
93. Brennan K.M., Burris W.R., Boling J.A., Matthews J.C. Selenium content in blood fractions and liver of beef heifers is greater with a mix of inorganic/organic or organic versus inorganic supplemental selenium but the time required for maximal assimilation is tissue-specific. Biol. Trace Elem. Res. 2011;144:504–516. doi: 10.1007/s12011-011-9069-y. [PubMed] [CrossRef] [Google Scholar]
94. Liao S.F., Brown K.R., Stromberg A.J., Burris W.R., Boling J.A., Matthews J.C. Dietary supplementation of selenium in inorganic and organic forms differentially and commonly alters blood and liver selenium concentrations and liver gene expression profiles of growing beef heifers. Biol. Trace Elem. Res. 2011;140:151–169. doi: 10.1007/s12011-010-8685-2. [PubMed] [CrossRef] [Google Scholar]
95. Watanabe T., Endo A. Effects of selenium deficiency on sperm morphology and spermatocyte chromosomes in mice. Mutat. Res. Lett. 1991;262:93–99. doi: 10.1016/0165-7992(91)90113-I. [PubMed] [CrossRef] [Google Scholar]
96. Kaur P., Bansal M.P. Effect of selenium-induced oxidative stress on the cell kinetics in testis and reproductive ability of male mice. Nutrition. 2005;21:351–357. doi: 10.1016/j.nut.2004.05.028. [PubMed] [CrossRef] [Google Scholar]
97. Adegoke E., Wang X., Wang H., Wang C., Zhang H., Zhang G. Selenium (Na 2 SeO 3) Upregulates Expression of Immune Genes and Blood–Testis Barrier Constituent Proteins of Bovine Sertoli Cell In Vitro. Biol. Trace Elem. Res. 2018;185:332–343. doi: 10.1007/s12011-018-1248-7. [PubMed] [CrossRef] [Google Scholar]
98. Adegoke E., Xue W., Machebe N., Adeniran S., Hao W., Chen W., Han Z., Guixue Z., Peng Z. Sodium Selenite inhibits mitophagy, downregulation and mislocalization of blood–testis barrier proteins of bovine Sertoli cell exposed to microcystin-leucine arginine (MC-LR) via TLR4/NF-kB and mitochondrial signaling pathways blockage. Ecotoxicol. Environ. Saf. 2018;166:165–175. doi: 10.1016/j.ecoenv.2018.09.073. [PubMed] [CrossRef] [Google Scholar]
99. Kaushal N., Bansal M. Inhibition of CDC2/Cyclin B1 in response to selenium-induced oxidative stress during spermatogenesis: Potential role of Cdc25c and p21. Mol. Cell. Biochem. 2007;298:139–150. doi: 10.1007/s11010-006-9360-y. [PubMed] [CrossRef] [Google Scholar]
100. Kaushal N., Bansal M. Selenium variation induced oxidative stress regulates p53 dependent germ cell apoptosis: Plausible involvement of HSP70-2. Eur. J. Nutr. 2009;48:221–227. doi: 10.1007/s00394-009-0005-2. [PubMed] [CrossRef] [Google Scholar]
101. Shalini S., Bansal M. Alterations in selenium status influences reproductive potential of male mice by modulation of transcription factor NFκB. Biometals. 2007;20:49–59. doi: 10.1007/s10534-006-9014-2. [PubMed] [CrossRef] [Google Scholar]
102. Shalini S., Bansal M.P. Role of selenium in spermatogenesis: Differential expression of cjun and cfos in tubular cells of mice testis. Mol. Cell. Biochem. 2006;292:27–38. doi: 10.1007/s11010-006-9168-9. [PubMed] [CrossRef] [Google Scholar]
103. Shalini S., Bansal M. Role of selenium in regulation of spermatogenesis: Involvement of activator protein 1. Biofactors. 2005;23:151–162. doi: 10.1002/biof.5520230304. [PubMed] [CrossRef] [Google Scholar]
104. Kaushal N., Bansal M. Diminished reproductive potential of male mice in response to selenium-induced oxidative stress: Involvement of HSP70, HSP70-2, and MSJ-1. J. Biochem. Mol. Toxicol. 2009;23:125–136. doi: 10.1002/jbt.20276. [PubMed] [CrossRef] [Google Scholar]
105. Sattar H., Yang J., Zhao X., Cai J., Liu Q., Ishfaq M., Yang Z., Chen M., Zhang Z., Xu S. Selenoprotein-U (SelU) knockdown triggers autophagy through PI3K–Akt–mTOR pathway inhibition in rooster Sertoli cells. Metallomics. 2018;10:929–940. doi: 10.1039/C8MT00090E. [PubMed] [CrossRef] [Google Scholar]
106. Bano I., Malhi M., Soomro S., Kandhro S., Awais M., Baloch S., Perveen S., Sajjad H. Effect of Dietary Selenium Supplementation on Morphology and Antioxidant Status in Testes of Goat. J. Basic Appl. Sci. 2018;14:53–61. doi: 10.6000/1927-5129.2018.14.08. [CrossRef] [Google Scholar]
107. Stefanov R., Chervenkov M., Anev G., Maksimović N., Andreeva M., Ivanova T., Milovanović A. Effect of supplementation with inorganic and organic selenium on sperm quality and quantity in north-east Bulgarian merino rams. Biotechnol. Anim. Husb. 2018;34:69–81. doi: 10.2298/BAH1801069S. [CrossRef] [Google Scholar]
108. Asri-Rezaei S., Nourian A., Shalizar-Jalali A., Najafi G., Nazarizadeh A., Koohestani M., Karimi A. Selenium supplementation in the form of selenium nanoparticles and selenite sodium improves mature male mice reproductive performances. Iran. J. Basic Med Sci. 2018;21:577. [PMC free article] [PubMed] [Google Scholar]
109. Martins S.M.M.K., Afonso E.R., Parazzi L.J., Andrade A.F.C.D., Leal D.F., Gameiro A.H., Moretti A.D.S.A., Arruda R.P.D. Organic selenium supplementation is cost-effective for increasing the number of seminal doses produced by sexually mature boars. Rev. Bras. Zootec. 2018;47 doi: 10.1590/rbz4720160328. [CrossRef] [Google Scholar]
110. Liu L., He Y., Xiao Z., Tao W., Zhu J., Wang B., Liu Z., Wang M. Effects of selenium nanoparticles on reproductive performance of male Sprague-Dawley rats at supranutritional and nonlethal levels. Biol. Trace Elem. Res. 2017;180:81–89. doi: 10.1007/s12011-017-0980-8. [PubMed] [CrossRef] [Google Scholar]
111. Zhou J.-C., Zheng S., Mo J., Liang X., Xu Y., Zhang H., Gong C., Liu X.-L., Lei X.G. Dietary selenium deficiency or excess reduces sperm quality and testicular mRNA abundance of nuclear glutathione peroxidase 4 in rats. J. Nutr. 2017;147:1947–1953. doi: 10.3945/jn.117.252544. [PubMed] [CrossRef] [Google Scholar]
112. Ibrahim H.A., Zhu Y., Wu C., Lu C., Ezekwe M.O., Liao S.F., Haung K. Selenium-enriched probiotics improves murine male fertility compromised by high fat diet. Biol. Trace Elem. Res. 2012;147:251–260. doi: 10.1007/s12011-011-9308-2. [PubMed] [CrossRef] [Google Scholar]
113. Shalini S., Bansal M. Dietary selenium deficiency as well as excess supplementation induces multiple defects in mouse epididymal spermatozoa: Understanding the role of selenium in male fertility. Int. J. Androl. 2008;31:438–449. doi: 10.1111/j.1365-2605.2007.00789.x. [PubMed] [CrossRef] [Google Scholar]
114. Sánchez-Gutiérrez M., García-Montalvo E., Izquierdo-Vega J., Del Razo L. Effect of dietary selenium deficiency on the in vitro fertilizing ability of mice spermatozoa. Cell Biol. Toxicol. 2008;24:321–329. doi: 10.1007/s10565-007-9044-8. [PubMed] [CrossRef] [Google Scholar]
115. Mohammadi S., Movahedin M., Mowla S.J. Up-regulation of CatSper genes family by selenium. Reprod. Biol. Endocrinol. 2009;7:126. doi: 10.1186/1477-7827-7-126. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
116. Abdel-Wareth A., Ahmed A., Hassan H., El-Sadek M.A., Ghazalah A., Lohakare J. Nutritional impact of nano-selenium, garlic oil, and their combination on growth and reproductive performance of male Californian rabbits. Anim. Feed Sci. Technol. 2019;249:37–45. doi: 10.1016/j.anifeedsci.2019.01.016. [CrossRef] [Google Scholar]
117. Baiomy A., Mohamed A., Mottelib A. Effect of dietary selenium and vitamin E supplementation on productive and reproductive performance in rams; Proceedings of the 14th International Congress of the International Society for Animal Hygiene (ISAH); Vechta, Germany. 9–23 July 2009; pp. 43–46. [Google Scholar]
118. Jacyno E., Kawecka M., Kamyczek M. Influence of inorganic Se+ vitamin E and organic Se+ vitamin E on reproductive performance of young boars. Agric. Food Sci. 2002;11:175–184. doi: 10.23986/afsci.5723. [CrossRef] [Google Scholar]
119. Hajalshaikh A., Al-Hassan M., Mohamed H. The influence of injectable sodium selenite on semen characteristics and testosterone concentration in Aardi goats. Indian J. Anim. Res. 2015;49:793–797. doi: 10.18805/ijar.7041. [CrossRef] [Google Scholar]
120. Martins S.M.M.K., De Andrade A., Zaffalon F.G., Parazzi L.J., Bressan F.F., Pugine S.M.P., Melo M.P.d., Chiaratti M., Marino C.T., Afonso E.R. Organic selenium increases PHGPx, but does not affect quality sperm in raw boar semen. Livest. Sci. 2014;164:175–178. doi: 10.1016/j.livsci.2014.02.018. [CrossRef] [Google Scholar]
121. Petrujkić B., Šefer D., Jovanović I., Jovičin M., Janković S., Jakovljević G., Beier R., Anderson R. Effects of commercial selenium products on glutathione peroxidase activity and semen quality in stud boars. Anim. Feed Sci. Technol. 2014;197:194–205. doi: 10.1016/j.anifeedsci.2014.09.001. [CrossRef] [Google Scholar]
122. El-Sharawy M., Eid E., Darwish S., Abdel-Razek I., Islam M.R., Kubota K., Yamauchi N., El-Shamaa I. Effect of organic and inorganic selenium supplementation on semen quality and blood enzymes in buffalo bulls. Anim. Sci. J. 2017;88:999–1005. doi: 10.1111/asj.12736. [PubMed] [CrossRef] [Google Scholar]
123. Lukusa K., Lehloenya K. Selenium supplementation improves testicular characteristics and semen quality of Saanen bucks. Small Rumin. Res. 2017;151:52–58. doi: 10.1016/j.smallrumres.2017.04.016. [CrossRef] [Google Scholar]
124. Anchordoquy J.P., Anchordoquy J.M., Lizarraga R.M., Nikoloff N., Pascua A.M., Furnus C.C. The importance of trace minerals copper, manganese, selenium and zinc in bovine sperm–zona pellucida binding. Zygote. 2019:1–8. doi: 10.1017/S0967199419000078. [PubMed] [CrossRef] [Google Scholar]
125. Roychoudhury S., Sharma R., Sikka S., Agarwal A. Diagnostic application of total antioxidant capacity in seminal plasma to assess oxidative stress in male factor infertility. J. Assist. Reprod. Genet. 2016;33:627–635. doi: 10.1007/s10815-016-0677-5. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
126. Gharagozloo P., Gutiérrez-Adán A., Champroux A., Noblanc A., Kocer A., Calle A., Pérez-Cerezales S., Pericuesta E., Polhemus A., Moazamian A. A novel antioxidant formulation designed to treat male infertility associated with oxidative stress: Promising preclinical evidence from animal models. Hum. Reprod. 2016;31:252–262. doi: 10.1093/humrep/dev302. [PubMed] [CrossRef] [Google Scholar]
127. Anel-López L., Ortega-Ferrusola C., Martínez-Rodríguez C., Álvarez M., Borragán S., Chamorro C., Peña F., Anel L., de Paz P. Analysis of seminal plasma from brown bear (Ursus arctos) during the breeding season: Its relationship with testosterone levels. PLoS ONE. 2017;12:e0181776. doi: 10.1371/journal.pone.0181776. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
128. Bertelsmann H., Keppler S., Höltershinken M., Bollwein H., Behne D., Alber D., Bukalis G., Kyriakopoulos A., Sieme H. Selenium in blood, semen, seminal plasma and spermatozoa of stallions and its relationship to sperm quality. Reprod. Fertil. Dev. 2010;22:886–891. doi: 10.1071/RD10032. [PubMed] [CrossRef] [Google Scholar]
129. Hawkes W.C., Turek P.J. Effects of dietary selenium on sperm motility in healthy men. J. Androl. 2001;22:764–772. [PubMed] [Google Scholar]
130. Domosławska A., Zdunczyk S., Franczyk M., Kankofer M., Janowski T. Selenium and vitamin E supplementation enhances the antioxidant status of spermatozoa and improves semen quality in male dogs with lowered fertility. Andrologia. 2018:e13023. doi: 10.1111/and.13023. [PubMed] [CrossRef] [Google Scholar]
131. Domosławska A., Zduńczyk S., Niżański W., Jurczak A., Janowski T. Effect of selenium and vitamin E supplementation on semen quality in dogs with lowered fertility. Bull. Vet. Inst. Pulawy. 2015;59:85–90. doi: 10.1515/bvip-2015-0013. [CrossRef] [Google Scholar]
132. Butt M.A., Shahid M.Q., Bhatti J.A., Khalique A. Effect of Dietary Vitamin E and Selenium Supplementation on Physiological Responses and Reproductive Performance in Holstein Friesian Bulls during Humid Hot Summer. Pak. Vet. J. 2019:1–5. doi: 10.29261/pakvetj/2019.053. [CrossRef] [Google Scholar]
133. Ghorbani A., Moeini M.M., Souri M., Hajarian H. Influences of dietary selenium, zinc and their combination on semen characteristics and testosterone concentration in mature rams during breeding season. J. Appl. Anim. Res. 2018;46:813–819. doi: 10.1080/09712119.2017.1406858. [CrossRef] [Google Scholar]
134. Kirchhoff K., Failing K., Goericke-Pesch S. Effect of dietary vitamin E and selenium supplementation on semen quality in Cairn Terriers with normospermia. Reprod. Domest. Anim. 2017;52:945–952. doi: 10.1111/rda.13000. [PubMed] [CrossRef] [Google Scholar]
135. Alonge S., Melandri M., Leoci R., Lacalandra G.M., Caira M., Aiudi G.G. The Effect of Dietary Supplementation of Vitamin E, Selenium, Zinc, Folic Acid, and N-3 Polyunsaturated Fatty Acids on Sperm Motility and Membrane Properties in Dogs. Animals. 2019;9:34. doi: 10.3390/ani9020034. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
136. Domosławska A., Zduńczyk S., Janowski T. Improvement of sperm motility within one month under selenium and vitamin E supplementation in four infertile dogs with low selenium status. J. Vet. Res. 2019 doi: 10.2478/jvetres-2019-0025. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
137. Ran M.-X., Li Y., Zhang Y., Liang K., Ren Y.-N., Zhang M., Zhou G.-B., Zhou Y.-M., Wu K., Wang C.-D. Transcriptome Sequencing Reveals the Differentially Expressed lncRNAs and mRNAs Involved in Cryoinjuries in Frozen-Thawed Giant Panda (Ailuropoda melanoleuca) Sperm. Int. J. Mol. Sci. 2018;19:3066. doi: 10.3390/ijms19103066. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
138. Dai D.-H., Qazi I.H., Ran M.-X., Liang K., Zhang Y., Zhang M., Zhou G.-B., Angel C., Zeng C.-J. Exploration of miRNA and mRNA Profiles in Fresh and Frozen-Thawed Boar Sperm by Transcriptome and Small RNA Sequencing. Int. J. Mol. Sci. 2019;20:802. doi: 10.3390/ijms20040802. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
139. Jamali N.U., Kaka A., Khatri P., Malhi M., Naeem M., Memon A.A., Kaleri R.R., Janyaro H., Kalhoro D.H. Effect of in vitro Selenium Addition to the Semen Extender on the Spermatozoa Characteristics before and after Freezing in Kundhi Buffalo Bull and in vivo Fertility Rate. Pak. J. Zool. 2019;51:317–323. doi: 10.17582/journal.pjz/2019.51.1.317.323. [CrossRef] [Google Scholar]
140. Khalil W.A., El-Harairy M.A., Zeidan A.E., Hassan M.A. Impact of selenium nano-particles in semen extender on bull sperm quality after cryopreservation. Theriogenology. 2019;126:121–127. doi: 10.1016/j.theriogenology.2018.12.017. [PubMed] [CrossRef] [Google Scholar]
141. Graupner A., Instanes C., Andersen J.M., Brandt-Kjelsen A., Dertinger S.D., Salbu B., Brunborg G., Olsen A.-K. Genotoxic effects of two-generational selenium deficiency in mouse somatic and testicular cells. Mutagenesis. 2015;30:217–225. doi: 10.1093/mutage/geu059. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
142. Taghizadeh L., Eidi A., Mortazavi P., Rohani A.H. Effect of selenium on testicular damage induced by varicocele in adult male Wistar rats. J. Trace Elem. Med. Biol. 2017;44:177–185. doi: 10.1016/j.jtemb.2017.08.003. [PubMed] [CrossRef] [Google Scholar]
143. Gan X., Zhang X., Qiannan E., Zhang Q., Ye Y., Cai Y., Han A., Tian M., Wang C., Su Z. Nano-selenium attenuates nickel-induced testosterone synthesis disturbance through inhibition of MAPK pathways in Sprague-Dawley rats. Environ. Toxicol. 2019 doi: 10.1002/tox.22768. [PubMed] [CrossRef] [Google Scholar]
144. Kaur S., Saluja M., Bansal M. Bisphenol A induced oxidative stress and apoptosis in mice testes: Modulation by selenium. Andrologia. 2018;50:e12834. doi: 10.1111/and.12834. [PubMed] [CrossRef] [Google Scholar]
145. Long M., Yang S., Wang Y., Li P., Zhang Y., Dong S., Chen X., Guo J., He J., Gao Z. The protective effect of selenium on chronic zearalenone-induced reproductive system damage in male mice. Molecules. 2016;21:1687. doi: 10.3390/molecules21121687. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
146. Rashad M.M., Galal M.K., Abou-El-Sherbini K.S., El-Behairy A.M., Gouda E.M., Moussa S.Z. Nano-sized selenium attenuates the developmental testicular toxicity induced by di-n-butyl phthalate in pre-pubertal male rats. Biomed. Pharmacother. 2018;107:1754–1762. doi: 10.1016/j.biopha.2018.09.006. [PubMed] [CrossRef] [Google Scholar]
147. EL-Maraghy S.A., Nassar N.N. Modulatory effects of lipoic acid and selenium against cadmium-induced biochemical alterations in testicular steroidogenesis. J. Biochem. Mol. Toxicol. 2011;25:15–25. doi: 10.1002/jbt.20354. [PubMed] [CrossRef] [Google Scholar]
148. Cao Z., Shao B., Xu F., Liu Y., Li Y., Zhu Y. Protective effect of selenium on aflatoxin B1-induced testicular toxicity in mice. Biol. Trace Elem. Res. 2017;180:233–238. doi: 10.1007/s12011-017-0997-z. [PubMed] [CrossRef] [Google Scholar]
149. Oda S.S., El-Maddawy Z.K. Protective effect of vitamin E and selenium combination on deltamethrin-induced reproductive toxicity in male rats. Exp. Toxicol. Pathol. 2012;64:813–819. doi: 10.1016/j.etp.2011.03.001. [PubMed] [CrossRef] [Google Scholar]
150. Dkhil M., Zrieq R., Al-Quraishy S., Abdel Moneim A. Selenium nanoparticles attenuate oxidative stress and testicular damage in streptozotocin-induced diabetic rats. Molecules. 2016;21:1517. doi: 10.3390/molecules21111517. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
151. Rungsung S., Khan A.M., Sood N.K., Rampal S., Saini S.P.S. Evaluation of ameliorative potential of supranutritional selenium on enrofloxacin-induced testicular toxicity. Chem.-Biol. Interact. 2016;252:87–92. doi: 10.1016/j.cbi.2016.04.018. [PubMed] [CrossRef] [Google Scholar]
152. Zhang X., Gan X.E.Q., Zhang Q., Ye Y., Cai Y., Han A., Tian M., Wang Y., Wang C. Ameliorative effects of nano-selenium against NiSO4-induced apoptosis in rat testes. Toxicol. Mech. Methods. 2019:1–36. doi: 10.1080/15376516.2019.1611979. [PubMed] [CrossRef] [Google Scholar]
153. Aydin S., Erkekoglu P., Başaran N., Kocer-Gumusel B. Impact of selenium status on Aroclor 1254-induced DNA damage in sperm and different tissues of rats. Toxicol. Mech. Methods. 2018;28:252–261. doi: 10.1080/15376516.2017.1397234. [PubMed] [CrossRef] [Google Scholar]
154. Kheradmand N., Kamkar R., Moshajjari M., Baazm M. Effect of selenium and pentoxifylline on expression of CATSPER1 and 2 genes and FSH/LH levels in treated mice by dexamethasone. Andrologia. 2019:e13279. doi: 10.1111/and.13279. [PubMed] [CrossRef] [Google Scholar]
155. Isidori A.M., Pozza C., Gianfrilli D., Isidori A. Medical treatment to improve sperm quality. Reprod. Biomed. Online. 2006;12:704–714. doi: 10.1016/S1472-6483(10)61082-6. [PubMed] [CrossRef] [Google Scholar]
156. Smits R.M., Mackenzie-Proctor R., Yazdani A., Stankiewicz M.T., Jordan V., Showell M.G. Antioxidants for male subfertility. Cochrane Database Syst. Rev. 2019:14. doi: 10.1002/14651858.CD007411.pub4. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
157. Steiner A., Hansen K., Diamond M., Coutifaris C., Cedars M., Legro R., Usadi R., Baker V., Coward R., Santoro N. Antioxidants in the treatment of male factor infertility: Results from the double blind, multi-center, randomized controlled Males, Antioxidants, and Infertility (MOXI) trial. Hum. Reprod. 2018;33:i30. [Google Scholar]
158. Aktan G., Doğru-Abbasoğlu S., Küçükgergin C., Kadıoğlu A., Özdemirler-Erata G., Koçak-Toker N. Mystery of idiopathic male infertility: Is oxidative stress an actual risk? Fertil. Steril. 2013;99:1211–1215. doi: 10.1016/j.fertnstert.2012.11.045. [PubMed] [CrossRef] [Google Scholar]
159. Rezaeian Z., Yazdekhasti H., Nasri S., Rajabi Z., Fallahi P., Amidi F. Effect of selenium on human sperm parameters after freezing and thawing procedures. Asian Pac. J. Reprod. 2016;5:462–466. doi: 10.1016/j.apjr.2016.11.001. [CrossRef] [Google Scholar]
160. Ghafarizadeh A., Vaezi G., Shariatzadeh M., Malekirad A. Effect of in vitro selenium supplementation on sperm quality in asthenoteratozoospermic men. Andrologia. 2018;50:e12869. doi: 10.1111/and.12869. [PubMed] [CrossRef] [Google Scholar]
161. Scott R., MacPherson A., Yates R. Selenium supplementation in sub-fertile human males. Br. J. Urol. 1998;82:76–80. doi: 10.1046/j.1464-410x.1998.00683.x. [PubMed] [CrossRef] [Google Scholar]
162. Hawkes W.C., Alkan Z., Wong K. Selenium supplementation does not affect testicular selenium status or semen quality in North American men. J. Androl. 2009;30:525–533. doi: 10.2164/jandrol.108.006940. [PubMed] [CrossRef] [Google Scholar]
163. Zadeh A.A., Arab D., Kia N.S., Heshmati S., Amirkhalili S.N. The role of Vitamin E–Selenium-Folic acid supplementation in improving the sperm parameters after varicocelectomy: A randomized clinical trial. Urol. J. 2019 doi: 10.22037/uj.v0i0.4653. [PubMed] [CrossRef] [Google Scholar]
164. Mossa M., Azzawi M., Dekhel H. Effect of Selenium in Treatment of Male Infertility. Exp. Tech. Urol. Nephrol. 2018;1:ETUN.000521. [Google Scholar]
165. Busetto G.M., Koverech A., Messano M., Antonini G., De Berardinis E., Gentile V. Prospective open-label study on the efficacy and tolerability of a combination of nutritional supplements in primary infertile patients with idiopathic astenoteratozoospermia. Arch. Ital. Urol. 2012;84:137–140. [PubMed] [Google Scholar]
166. Lombardo F., Fiducia M., Lunghi R., Marchetti L., Palumbo A., Rizzo F., Koverech A., Lenzi A., Gandini L. Effects of a dietary supplement on chronic pelvic pain syndrome (Category IIIA), leucocytospermia and semen parameters. Andrologia. 2012;44:672–678. doi: 10.1111/j.1439-0272.2011.01248.x. [PubMed] [CrossRef] [Google Scholar]
167. Moslemi M.K., Tavanbakhsh S. Selenium-vitamin E supplementation in infertile men: Effects on semen parameters and pregnancy rate. Int. J. Gen. Med. 2011;4:99–104. doi: 10.2147/IJGM.S16275. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
168. Rayman M.P., Winther K.H., Pastor-Barriuso R., Cold F., Thvilum M., Stranges S., Guallar E., Cold S. Effect of long-term selenium supplementation on mortality: Results from a multiple-dose, randomised controlled trial. Free Radic. Biol. Med. 2018;127:46–54. doi: 10.1016/j.freeradbiomed.2018.02.015. [PubMed] [CrossRef] [Google Scholar]